Молекул. Закон Дальтона.
При переходе к равновесию от одной части газа к другой передается энергия. Выравнивается не энергия всего газа как целого, а средняя кинетическая энергия, отнесенная к одной молекуле. Температура газа пропорциональна средней кинетической энергии его молекул: Т ~ 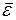 . Средняя кинетическая энергия поступательного движения молекулы
. Средняя кинетическая энергия поступательного движения молекулы
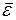 = = 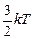 , ,
| (6.4.1) |
где k - постоянная Больцмана, выражающая соотношение между единицей энергии и единицей температуры: k=1,38·10-23 Дж/К.
Все молекулы при данной температуре Т имеют одну и ту же среднюю энергию независимо от их сорта. Из формулы (6.4.1) следует, что абсолютная температура является мерой средней кинетической энергии поступательного хаотического движения молекул. При Т=0 замирает тепловое движение, но остаются другие, нетепловые формы движения в веществе, например, движение электронов в атоме. Это движение нельзя прекратить, охлаждая вещество.
Выразим теперь uкв через абсолютную температуру Т. Приравнивая правые части в формулах 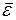 =
= 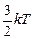 и
и 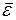
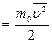 получим uкв=
получим uкв= 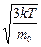 .
.
Введем понятие универсальной газовой постоянной R, которая связана с постоянной Больцмана соотношением 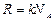 , где NA=6·1023моль-1 – число Авогадро (число молекул в одном моле вещества), и молярной массы m= Nam0 –массы одного моля газа. Тогда среднюю квадратичную скорость поступательного движения молекул можно выразить формулой:
, где NA=6·1023моль-1 – число Авогадро (число молекул в одном моле вещества), и молярной массы m= Nam0 –массы одного моля газа. Тогда среднюю квадратичную скорость поступательного движения молекул можно выразить формулой:
uкв= 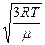 . .
| (6.4.2) |
Подставляя в основное уравнение кинетической теории газов это выражение, получим, что давление идеального газа связано с температурой соотношением:
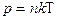 . .
| (6.4.3) |
Давление определяется только концентрацией (при постоянной температуре) и не зависит от сорта молекул.
Если имеем смесь нескольких газов, концентрация молекул которых n1, n2, ..., ni и 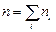 , то
, то
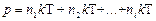 .
.
Давления 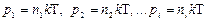 называют парциальными давлениями. Например, р1 – парциальное давление соответствует давлению, которое оказывал бы первый газ, входящий в состав смеси, если бы он занимал весь объем.
называют парциальными давлениями. Например, р1 – парциальное давление соответствует давлению, которое оказывал бы первый газ, входящий в состав смеси, если бы он занимал весь объем.
Согласно закону Дальтона в случае идеальных газов
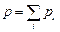 . .
| (6.4.4) |
Таким образом, давление, оказываемое на стенки сосуда смесью газов, равно сумме парциальных давлений отдельных компонентов смеси.
Дата добавления: 2016-12-09; просмотров: 1379;











