Молекулярные кристаллы
К молекулярным кристаллам относят твердые тела, в узлах кристаллической решетки которых располагаются либо одинаковые молекулы с насыщенными связями (H2, Сl2, Вг2, I2), либо атомы инертных газов (Аг, Ne, Кг, Хе, Rn).К группе инертных газов следовало бы также отнести и гелий. Однако силы взаимодействия между атомами гелия настолько слабы (энергия сцепления без учета нулевых колебаний составляет всего лишь 0,75-10-3 эВ), а квантово-механическая энергия атомов по сравнению с этими силами настолько велика, что эта энергия является преобладающей. Это обстоятельство приводит к тому, что при нормальном давлении гелий остается жидким вплоть до0К. Для того чтобы перевести гелий в твердое состояние, требуется давление 2,5. 106 Па,
Одной из характерных особенностей молекулярных кристаллов является то, что частицы (атомы, молекулы) в кристалле удерживаются вместе очень слабыми силами Ван-дер-Ваальса.Энергия, сцепления молекулярных кристаллов очень мала и составляет 0,02—0,15 эВ (сравните с энергией сцепления ионных кристаллов: так для NaCl энергия сцепления порядка 8 эВ). Такие небольшие энергии сцепления обусловливают очень низкие температуры плавления этих кристаллов.
Наличие сил Ван-дер-Ваальса отражает тот факт, что нейтральный изотропный атом (нейтральная молекула) может поляризоваться под влиянием электрического поля, причем даже два нейтральных изотропных атома индуцируют друг в друге малые дипольные электрические моменты. Происхождение сил Ван-дер-Ваальса можно объяснить исходя из следующих простых соображений, В атомах инертных газов внешние электроны образуют очень прочные устойчивые группировки из восьми электронов в состояниях s2р6, вследствие чего на движение электронов слабо влияет присутствие соседних атомов. В среднем распределение заряда в изолированном атоме имеет сферическую симметрию (рис.3.2), положительный заряд ядра равен отрицательному заряду всех электронов, окружающих ядро, атом является электрически нейтральным, и центры зарядов лежат в центре ядра.
Если два таких атома находятся относительно далеко друг от друга, то они не взаимодействуют между собой (рис 3.2). При сближении атомов подвижный отрицательный заряд (облако) одного из атомов в какой-то момент времени может оказатьсясмещенным,так что центры положительных и отрицательных зарядов уже не будут совпадать, в результате возникнет мгновенный дипольный электрический момент. Такое разделение зарядов (флуктуация) может возникать из-за увеличения энергии атома, например, в результате столкновения с другой частицей. Таким образом, в каждый отдельный момент времени атом может обладать отличным от нуля дипольным электрическим моментом, хотя в среднем по времени этот момент равен нулю.
Мгновенный дипольный момент атома создает в центре другого атома электрическое поле, которое наводит в нем также мгновенный дипольный момент, т. е. и в этом атоме происходит разделение зарядов. Таким образом, по мере приближения двух атомов друг к другу их стабильная конфигурация становится эквивалентной двум электрическим диполям (рис 3.3).

Так как притяжение более близких друг к другу противоположных зарядов (рис.3.2) увеличивается при сближении сильнее, чем отталкивание более далеких одноименных зарядов, то результатом будет притяжение атомов друг к другу.
Квантово-механический расчет этих сил притяжения для системы из двух идентичных гармонических осцилляторов,находящихся на расстоянии т один от другого, был выполнен Г. Лондоном (1930). Было получено, что полная энергия двух взаимодействующих осцилляторе уменьшается из-за взаимодействия на величину, обратно пропорциональную шестой степени расстояния между ними:
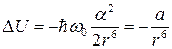 , (3.6)
, (3.6)
где 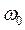 — собственная частота простого гармонического осциллятора;
— собственная частота простого гармонического осциллятора; 
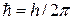 — постоянная Планка;
— постоянная Планка; 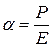 — поляризуемость осциллятора (атома); Р — дипольный момент; Е—напряженность электрического поля; а — постоянная.
— поляризуемость осциллятора (атома); Р — дипольный момент; Е—напряженность электрического поля; а — постоянная.
Поляризуемость, как известно, определяет также оптические свойства кристаллов, в частности дисперсию света (изменение скорости света и показателя преломления среды в зависимости от частоты), поэтому молекулярные силы иногда называют дисперсионными.
Молекулярные силы действуют не только между атомами инертных газов, но и между любыми другими атомами, когда они находятся достаточно близко друг к другу, т. е. так, что движение электронов в соседних атомах не претерпевает радикального изменения, а только испытывает слабое возмущение.
При дальнейшем уменьшении расстояния между атомами электронные оболочки начинают перекрываться и между атомами возникают значительные силы отталкивания. Отталкивание в случае инертных газов, главным образом, появляется в результате действия принципа запрета Паули.При перекрывании электронных оболочек электроны первого атома стремятся частично занять состояния второго. Поскольку атомы инертных газов имеют стабильные электронные оболочки, в которых все энергетические состояния уже заняты, то при перекрытии оболочек электроны должны переходить в свободные квантовые состояния с более высокой энергией, так как, согласно принципу Паули, электроны не могут занимать одну и ту же область пространства без увеличения их кинетической энергии. Увеличение кинетической энергии приводит к увеличению полной энергии системы двух взаимодействующих атомов, а значит, и к появлению сил отталкивания.
Для того чтобы суммарный потенциал типа (3.5) имел минимум, необходимо, чтобы на малых расстояниях потенциал сил отталкивания был больше потенциала сил притяжения. Принято потенциал сил отталкивания представлять в форме степенного закона: Uот = Ь/rn, где показатель n равен 12, хотя такой показатель не имеет столь надежного обоснования, как показатель 6 в потенциале сил притяжения, однако выражение Uот= Ь/r12 представляет простое и хорошее приближение.
Теперь полную потенциальную энергию взаимодействия между двумя атомами, находящимися на расстоянии rij друг от друга, можно записать в виде
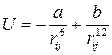 (3.7)
(3.7)
где а и Ь — положительные постоянные.
Обычно вместо (3.7) для описания взаимодействия электрически нейтральных атомов и электрически нейтральных и неполярных молекул используют потенциал Леннарда — Джонса:
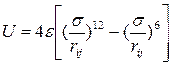 (3.8)
(3.8)
Потенциал (3.8) зависит от двух параметров: 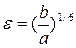 и
и 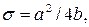 Параметр
Параметр 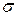 соответствует межатомному расстоянию,при котором полная потенциальная энергия равна нулю, а параметр
соответствует межатомному расстоянию,при котором полная потенциальная энергия равна нулю, а параметр 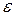 имеет размерность энергии и равен минимуму потенциальной энергии при
имеет размерность энергии и равен минимуму потенциальной энергии при 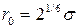 . Расстояние
. Расстояние 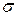 равно радиусу сферы непроницаемости взаимодействующих атомов, а r0 характеризует радиус действия межатомных сил. Параметры
равно радиусу сферы непроницаемости взаимодействующих атомов, а r0 характеризует радиус действия межатомных сил. Параметры 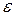 и
и 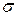 получают из экспериментальных измерений в газовой фазе термодинамических величин: вириальных коэффициентов, коэффициентов вязкости и коэффициентов Джоуля — Томсона в уравнения состояния газа.
получают из экспериментальных измерений в газовой фазе термодинамических величин: вириальных коэффициентов, коэффициентов вязкости и коэффициентов Джоуля — Томсона в уравнения состояния газа.
Ионные кристаллы
Ионные кристаллы представляют собой соединения с преобладающим ионным характером химической связи, в основе которой лежит электростатическое взаимодействие между заряженными ионами. Типичными представителями ионных кристаллов являются галогениды щелочных металлов, например, со структурой типа NaCl и СaСl.
При образовании кристаллов типа каменной соли (NaCl) атомы галогенов (F, Сl, Вг, I), обладающие большим сродством к электрону захватывают валентные электроны щелочных металлов (Li, Nа, К, Rb, I), имеющих низкие ионизационные потенциалы, при этом образуются положительные и отрицательные ионы, электронные оболочки которых подобны сферически симметричным заполненным s2p6-оболочкам ближайших инертных газов (например, оболочка N+ подобна оболочке Ne, а оболочка Сl- оболочке Аr). В результате кулоновского притяжения анионов и катионов происходит перекрытие шести внешних р-орбиталей и образуется решетка типа NаСl, симметрия которой и координационное число, равное 6, отвечают шести валентным связям каждого атома со своими соседями (Рис.3.4). Существенным является то, что приперекрытии р-орбиталей имеет место понижение номинальных зарядов (+1 для Nа и —1 для Сl) на ионах до небольших реальных значений вследствие сдвига электронной плотности в шести связях от аниона к катиону, так что реальный заряд атомов в соединении оказывается, например, для Nа равным +0,92е, а для Сl— отрицательный заряд становится также меньше —1 е.
Понижение номинальных зарядов атомов до реальных значений в соединениях свидетельствует о том, что даже при взаимодействии наиболее электроотрицательными электроположительных элементов образуются соединения, в которых связь не является чисто ионной.


По описанному механизму образуются не только галогениды щелочных металлов, но также нитриды, карбиды переходных металлов, большинство которых имеют структуру типа NаCl.
В силу того что ионная связь ненаправленна, ненасыщенна, для ионных кристаллов характерны большие координационные числа. Основные особенности строения ионных кристаллов хорошо описываются на основе принципа плотнейших упаковок из шаров определенных радиусов. Так, в структуре NаСl крупные анионы Сl образуют кубическую плотнейшую упаковку, в которой заселены все октаэдрические пустоты более мелкими по размеру катионами Na. Таковы структуры KCl, RbCl и многих других соединений.
К ионным кристаллам относятся большинство диэлектриков с высокими значениями удельного электрического сопротивления. Электропроводность ионных кристаллов при комнатной температуре более чем на двадцать порядков меньше электропроводности металлов. Электропроводность в ионных кристаллах осуществляется, в основном, ионами. Большинство ионных кристаллов прозрачны в видимой области электромагнитного спектра.
В ионных кристаллах притяжение обусловлено, главным образом, кулоновским взаимодействием между заряженными ионами. - Кроме притяжения между разноименно заряженными ионами существует также отталкивание, обусловленное, с одной стороны, отталкиванием одноименных зарядов, с другой — действием принципа запрета Паули, поскольку каждый ион обладает устойчивыми электронными конфигурациями инертных газов с заполненными оболочками. С точки зрения сказанного в простой модели ионного кристалла можно принять, что ионы представляют собой жесткие непроницаемые заряженные сферы, хотя реально под действием электрических полей соседних ионов сферически-симметричная форма ионов в результате поляризации несколько нарушается.
В условиях, когда существуют одновременно и силы притяжения и силы отталкивания, устойчивость ионных кристаллов объясняется тем, что расстояние между разноименными зарядами меньше, чем между одноименными. Поэтому силы притяжения преобладают над силами отталкивания.
Снова, как и в случае молекулярных кристаллов, при расчете энергии сцепления ионных кристаллов можно исходить из обычных классических представлений, считая, что ионы находятся в узлах кристаллической решетки (положениях равновесий), их кинетическая энергия пренебрежимо мала и силы, действующие между ионами, являются центральными.
Дата добавления: 2021-02-19; просмотров: 734;











