Ковалентные кристаллы
К ковалентным кристаллам относят твердые тела, кристаллическая структура которых образована за счет ковалентной связи.Типичными представителями кристаллов с чисто ковалентной связью являются: алмаз, кремний, германий, серое олово, которые построены по типу структуры алмаза (см. рис.3.5).


Существует большой класс алмазоподобных соединений АIIIВv,l АI BVI, АI ВVII со структурой типа сфалерита и вюрцита ), при образовании которых наряду с ковалентной связью всегда возникает дополнительная ионная компонента связи, которая увеличивается при переходе от соединений АIII ВV к соединениям АI ВVII. Ковалентные кристаллы, как правило, являются полупроводниками.
Ковалентная связь имеет то же происхождение, что и связь в гомополярных молекулах (Н2, Сl2, I2,...), она обусловлена обменным электронным взаимодействием между атомами, В молекулярных кристаллах (Н2, Сl2, I2,...) ковалентная связьсилами локализована между ядрами в молекуле, молекулы удерживаются вместе слабыми Ван-дер-Ваальса. Однако в случае алмаза или графита несколько валентных электронов являются общими для атома и ряда его соседей, и поэтому невозможно выделить какую-либо группу атомов, которую можно рассматривать как химически насыщенную. С этой точки зрения кристалл алмаза представляет собой огромную молекулу.
Если приписать соответствующие связи определенным парам атомов, то их можно рассматривать как парные и короткодействующие силы. Однако эти силы не всегда центральны. Так, например, в молекуле Н3 энергия химической связи зависит только от расстояния между атомами, а в алмазе существует тенденция к тому, чтобы соседние атомы располагались в определенном порядке, и для расчета энергии необходимо знать не только расстояния между атомами, но и значения валентных углов. В алмазе атом углерода находится в тетраэдрическом окружении других атомов углерода (рис. 3.6, 3.7) и угол а между двумя соседними связями составляет примерно 109°.

Количественное рассмотрение ковалентных сил связи очень сложно, поскольку при взаимодействии атомов движение электронов претерпевает радикальное изменение по сравнению с их движением в изолированных атомах, которое уже невозможно описать исходя из обычных классических представлений, а необходимо привлечение представлений квантовой механики.
Для понимания существа ковалентной связи мы ограничимся рассмотрением механизма образования молекулы водорода Н2 при взаимодействии двух атомов водорода.
Атом водорода в изолированном состоянии во внешней оболочке имеет 1s1 электрон, так что ему не хватает одного электрона для того, чтобы получилась полностью заполненная оболочка ближайшего к нему инертного газа гелия. При постепенном сближении двух атомов водорода возможно перекрытие электронных оболочек и переход электрона от атома ко второму, а второго—кпервому. При этом перекрытие может происходить без перехода электронов на более высокие энергетические уровни — электронные оболочки не полностью заполнены и принцип запрета Паули разрешает такое перекрытие.
Если энергия системы двух взаимодействующих атомов при перекрытии ниже, чем энергия системы, в которой атомы изолированы (т. е. находятся на сравнительно большом расстоянии друг от друга), то за счет перекрытия могут возникать силы притяжения, которые при дальнейшем сближении атомов сменятся быстро возрастающими силами отталкивания ядер. При некотором расстоянии между ядрами, соответствующем минимуму энергии системы, силы притяжения уравновесятся силами отталкивания и образуется молекула Н2, электронная оболочка которой подобна оболочке инертного газа гелия. В такой молекуле атомов водорода нет, в ней содержатся толькосоставные части этих атомов — два протона и два электрона. Электроны, которые входили в состав отдельных атомов, становятся общими для обоих ядер или, как говорят, электроны коллективизируются обоими ядрами. При этом, поскольку электроны совершенно одинаковы, то при их обмене местами состояние системы не меняется.
Переходя от молекулы водорода к кристаллам, отметим; основной характерной особенностью ковалентных кристаллов является то, что количество ковалентных связей, образуемых каждым атомом со своими соседями, равно количеству неспаренных внешних электронов атома в свободном состоянии или в возбужденном валентном состоянии. В этом смысле ковалентная связь является насыщенной. Дело в том, что атомы при взаимодействии могут возбуждать друг друга и производить распаривание электронов, т.е. переводить один из спаренных электронов в свободную ячейку на незанятый энергетический уровень.

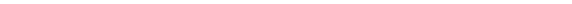
Так, например, структура типа алмаза у элементов IV группы, имеющих четыре внешних валентных электрона s2p2 (алмаз, Si, Ge,  ), возникает вследствие перехода одного s-электрона в р- состояние (рис. 3.8).
), возникает вследствие перехода одного s-электрона в р- состояние (рис. 3.8).
При взаимодействии атомов углерода один из 2s-электронов переходит в свободную 2р-ячейку, и уже у углерода на внешних оболочках получается четыре неспаренных электрона. В результате взаимного возбуждения все четыре электрона сместились со своих орбит и находятся на смешанных, или гибридных, орбитах. Это явление называется гибридизацией s- и р-электронов.
В алмазоподобных соединениях (сфалерит, вюрцит) образование четырех связей требует перехода одного—трех электронов от элементов V—VII групп к элементам I—III групп.Переход электронов и поляризация ведут к появлению эффективных зарядов на атомах, поэтому к ковалентной компоненте добавляется небольшая ионная компонента.
В заключение подчеркнем, что наиболее характерная черта ко--валентной связи — ее сильная направленность в пространстве, т. е, она образуется в тех направлениях, в которых локализуется электронная плотность. Вследствие направленности связи ковалентные кристаллы обладают высокой твердостью и хрупкостью.
Металлы
Металлические твердые тела в отличие от других типов твердых тел, обладают рядом интересных особенностей. К этим особенностям следует отнести высокую электропроводность, металлический блеск, связанный с большими коэффициентами отражения электромагнитных волн, высокую пластичность (ковкость) и др. Удельная электропроводность металлов при комнатных температурах составляет 108—106 Ом-1.м-1, тогда как типичные неметаллы, например кварц, проводят электрический ток примерно в 1024 раз хуже типичного металла серебра. Для металлов характерно возрастание электропроводности с понижением температуры. Из 103 элементов таблицы Менделеева только 19 не являются металлами.
Названные специфические свойства, по-существу, обусловлены наличием в металлах свободных электронов. Металлическая связь возникает при взаимодействии атомов электроположительных элементов, внешние валентные электроны которых связаны с ядром относительно слабо. При образовании твердого состояния в результате перекрытия волновых функций металлических атомов (например, атомов Na) движение электронов, как и в случае ковалентной связи,претерпевает радикальное изменение, иэлектроны обобществляются. При этом каждая соседняя пара электронов предпочла бы образовать молекулу, с тем чтобы поделить себя между двумя атомами. Но у каждого атома Nа в твердом состоянии имеется в среднем восемь соседей и только один валентный электрон, который должен быть поделен с каждым из этих соседей. В отличие от случая ковалентной связи, когда пара электронов, в основном, курсирует между двумя соседними атомами, коллективизированному электрону в металле приходится совершать довольно сложный путь, посещая по очереди каждый атом (положительный ион) твердого тела. В описанной ситуации все ионы обладают всеми электронами вместе, а электроны могут свободно перемещаться от одного иона к другому.
Итак, в металле внешние валентные электроны атомов коллективизированы и образуют газ или жидкость, заполняющую межионное пространство. Положительно заряженные ионы стягиваются отрицательно заряженным электронным газом в кристалл. Из сказанного следует, что связь в решетке металла возникает вследствие взаимодействия положительных ионов с электронным газом.
При расчетах энергии сцепления металлических кристаллов необходимо учитывать взаимодействие: атомных остатков друг с другом, атомных остатков с коллективизированными электронами и коллективизированных электронов друг с другом.
Взаимодействие положительных атомных остатков друг с другом не сводится только к их взаимному отталкиванию, а заключается также в перекрытии их внешних электронных оболочек, ведущем к образованию валентных связей. Именно это-то перекрытие и позволяет объяснить образование того или иного типа кристаллических структур.
Для грубой оценки энергии сцепления щелочных металлов' обычно пользуются ионной моделью. Согласно этой модели, положительно заряженные ионы, которые считают точечными, располагаются в узлах кристаллической решетки, а коллективизированные электроны равномерно распределены между ионами. Энергия сцепления металлического кристалла в такой модели может быть рассчитана с помощью методов, используемых при расчете энергии-сцепления ионных кристаллов.
Как показывают расчеты, энергия кулоновского притяжения,, приходящаяся на один атом, между положительными ионами отрицательно заряженными электронами для щелочных металлов,, кристаллизующихся по типу ОЦК- решетки, может быть представлена в виде (в эВ/атом):
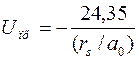 (3.9)
(3.9)
Здесь а0=0,529-10-10 м — боровский радиус; гs=[3/(4 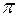 n)]1/3— радиус сферы, объем которой равен объему, приходящемуся на один коллективизированный электрон;
n)]1/3— радиус сферы, объем которой равен объему, приходящемуся на один коллективизированный электрон; 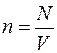 — концентрация
— концентрация
В коллективизированных электронах при равновесии силы притяжения должны уравновешиваться силами отталкивания. В металлах силы отталкивания связаны, в основном, с движением коллективизированных электронов, которые создают внутри металла давление. Внутреннее давление, создаваемое электронами, связано с их кинетической энергией, поэтому, очевидно, что притяжение должно уравновешивать кинетическую энергию электронов.
В металле свободные электроны определяют не только электрические и другие свойства, но и кристаллическую структуру. Наличие свободных электронов обусловливает ненаправленный и ненасыщенный характер металлической связи. Большинство металлов кристаллизуется в структурах, отвечающих плотнейшей шаровой упаковке атомов с максимальными координационными числами, равными 12 (ГЦК- и ГПУ-решетки). Ряд металлов также кристаллизуется в виде простых ОЦК-структур с координационным числом 8. Один и тот же элемент в зависимости от внешних условий может кристаллизоваться в виде различных структур (явление полиморфизма). Например, Li и Na при низких температурах образуют плотноупакованную гексагональную решетку, а при комнатных — кубическую объемно-центрированную. Практически многие металлы обладают свойством полиморфизма.
В зависимости от кристаллической структуры один и тот же элемент может быть либо металлом, либо полупроводником, либо диэлектриком. Например, известно, что белое олово — металл, а серое — полупроводник, углерод в виде алмаза — диэлектрик, а в виде графита он проявляет металлические свойства.
В заключение отметим, что некоторые черты ковалентной и молекулярной связи можно обнаружить и в металлах, особенно в благородных (Аu, Аg и др.), в атомах которых d-оболочки не очень сильно связаны с ядром, и поэтому при взаимодействии они испытывают существенные искажения.
Дата добавления: 2021-02-19; просмотров: 620;











