Атомные молекулярные и ионные вещества. Кристаллическая решетка.
Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение).
Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка. Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В узлах кристаллической решетки могут находиться ионы, атомы или молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток:
· ионные,
· атомные,
· молекулярные и
· металлические.
Ионная решетка
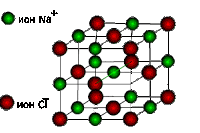
Эту решетку образуют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. В узлах решетки — ионы, между которыми существует электростатическое притяжение. Ионная связь очень прочная.
Примеры: КОН, СаСО3, СН3СООК, NH4NO3, [CH3NH3]Cl, С2Н5ОК.
Свойства ионных кристаллов:
· твердые, но хрупкие;
· отличаются высокими температурами плавления;
· нелетучи, не имеют запаха;
· расплавы ионных кристаллов обладают электропроводностью;
· многие растворимы в воде; при растворении в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Металлическая решетка
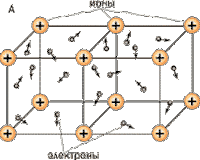
Характерна для веществ с металлической связью. Реализуется в простых веществах — металлах и их сплавах. В узлах решетки — атомы и катионы металла, при этом электроны металла обобществляются и образуют так называемый электронный газ, который движется между узлами решетки, обеспечивая ее устойчивость. Именно свободно перемещающимися электронами и обусловлены свойства веществ с металлической решеткой:
· тепло- и электропроводность;
· обладают металлическим блеском;
· высокие температуры плавления.
Атомная решетка
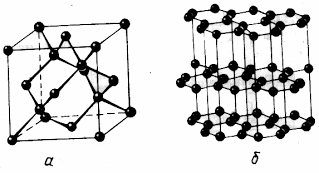
В узлах решетки — атомы, связанные ковалентными связями. Химическая связь — ковалентная полярная или неполярная. Атомная кристаллическая решетка характерна для углерода (алмаз, графит), бора, кремния, германия, оксида кремния SiO2(кремнезем, кварц, речной песок), карбида кремния SiC (карборунд), нитрида бора BN.
Свойства веществ с атомной решеткой:
· высокая твердость;
· высокие температуры плавления;
· нерастворимость;
· нелетучесть;
· отсутствие запаха.
| <== предыдущая лекция | | | следующая лекция ==> |
| Развитие внешнего дыхания. | | | Аварийные режимы работы электродвигателей |
Дата добавления: 2021-02-19; просмотров: 746;











