ИОННАЯ СВЯЗЬ И МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ
Чем больше DЭО атомов, образующих химическую связь, тем выше ее СИ, то есть больше эффективный заряд на атомах. При
DЭО > 1,9 величина эффективного заряда q > ½ 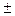 0,5е½ (см. рис. 1) и вполне допустимо рассматривать атомы как ионы с целочисленными зарядами. Химическая связь, возникающая между такими ионами, называется ионной.
0,5е½ (см. рис. 1) и вполне допустимо рассматривать атомы как ионы с целочисленными зарядами. Химическая связь, возникающая между такими ионами, называется ионной.
Электрическое поле, создаваемое ионами, является сферическим, поэтому каждый ион способен притягивать к себе независимо от направления сразу несколько ионов другого знака, количество которых зависит от размеров и зарядов взаимодействующих частиц. Таким образом, ионная связь, в отличие от КС, не насыщаема и не направлена.
Ионные соединения в твердом состоянии образуют ионные кристаллические решетки, характерными особенностями которых являются высокие значения энергии связи, температуры плавления и твердости. Кроме того, вещества с ионными или сильно полярными связями (соли, кислоты) способны к диссоциации на ионы в расплавах или растворах полярных растворителей, при этом диссоциация в первую очередь протекает по наиболее полярной связи. Свойства ионных соединений также во многом определяются взаимной поляризацией ионов, которая приводит к уменьшению СИ химической связи.
Поляризацией называют суммарный эффект, получающийся при сочетании поляризующего действия (ПД) ионов с их поляризуемостью. Поляризуемость – это способность электронного облака частицы к деформации под действием электростатического поля другого иона, а напряженность этого поля определяет ПД иона. На практике для определения эффекта поляризации можно принимать во внимание только ПД катиона и поляризуемость аниона.
ПД катиона тем значительнее, чем меньше радиус, больше его заряд и главное квантовое число внешних АО иона. Поэтому наиболее сильным ПД обладают катионы малых периодов. Поляризуемость аниона тем выше, чем больше его радиус, заряд и значение главного квантового числа внешних АО. При одинаковом значении главного квантового числа d-электроны поляризуются в большей степени, чем p- и s-электроны.
Усиление поляризующего действия катиона на анион приводит к ослаблению энергии связи между частицами и, как следствие, к сдвигу l в область видимой части спектра, то есть к появлению окраски у соединений.
Силы электростатического взаимодействия между молекулами, возникающие без передачи атомами электронов на расстояниях, превышающих длину связи, называются вандерваальсовыми силами. Различают три вида такого взаимодействия: ориентационное, индукционное и дисперсионное. Ориентационное взаимодействие проявляется между полярными молекулами, индукционное – при действии полярной молекулы на неполярную, а дисперсионное – является универсальным, так как проявляется в любых случаях.
Индукционное взаимодействие между молекулами является второстепенным, по сравнению с ориентационным и дисперсионным. С увеличением полярности молекул возрастает роль ориентационных сил, а повышение поляризуемости (деформируемости) частицы усиливает роль дисперсионного взаимодействия.
Наличие вандерваальсовых сил обусловливает притяжение молекул и агрегацию вещества с образованием молекулярных кристаллов. Такие силы гораздо слабее, чем ковалентная или ионная связь, поэтому вещества с молекулярно-кристаллическим строением характеризуются невысокими температурами плавления, способностью к возгонке и малой твердостью.
Промежуточное положение между химической связью и вандерваальсовыми взаимодействиями занимает водородная связь (ВС), которая возникает между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом F, O или N (реже – Cl или S), принадлежащим другой молекуле. ВС проявляется тем сильнее, чем больше ЭО и меньше радиус атома-партнера.
Возникновение ВС обусловлено способностью атома водорода глубоко внедряться в электронную оболочку атома с высокой ЭО из-за своего малого размера и отсутствия внутренних электронных слоев. Энергия ВС невелика (8 – 80 кДж/моль), поэтому такую связь легко разрушить.
Наличие ВС является причиной объединения молекул в димеры или более сложные ассоциаты, а также объясняет аномально высокие температуры кипения и плавления некоторых веществ, так как на разрыв таких связей требуется дополнительная затрата энергии.
Пример 1. Радиусы ионов Na+ и Cu+ – одинаковые (0,098 нм). Объясните различие температур плавления NaCl (801 °С) и CuCl (430 °С).
Р е ш е н и е
При одинаковых зарядах и размерах ионов Na+ и Cu+ различие в их поляризующем действии определяется особенностями их электронного строения (Cu+: …3s23p63d10 и Na+: …2s22p6). У иона Cu+ ПД выражено сильнее, чем у иона Na+, так как главное квантовое число внешних АО у первого иона равно 3, а у второго – 2. В результате связь в кристаллах CuCl является в меньшей степени ионной, чем в NaCl. Поэтому кристаллическая решетка NaCl более близка к чисто ионному типу и имеет более высокую температуру плавления, чем у CuCl.
Пример 2. CaF2 не распадается на атомы даже при 1000 °С, а CuI2 неустойчив уже при обычной температуре. Чем объяснить различную прочность этих соединений?
Р е ш е н и е
Ион Cu2+, имеющий небольшой радиус 0,08 нм (cм. табл. 5 приложения), обладает сильным ПД, а большой по размеру ион I– (r = 0,22 нм) характеризуется высокой поляризуемостью. Поэтому поляризация аниона I– катионом Cu2+ приводит к практически полному переходу электрона от аниона к катиону. В результате ион Cu2+ восстанавливается до Cu+, а ион I– окисляется до свободного йода. Поэтому соединение CuI2 неустойчивое.
Радиус иона Са2+ составляет 0,104 нм, поэтому он оказывает более слабое ПД на анион, чем ион Cu2+. С другой стороны, поляризуемость иона F–, имеющего сравнительно малый размер (r = 0,133 нм), значительно меньше, чем у иона I–. При взаимодействии слабополяризующего катиона Са2+ со слабо поляризующимся анионом F– электронные оболочки ионов почти не деформируются, СИ связи практически не снижается, поэтому соединение СаF2 устойчиво.
Пример 3. Почему изменяется интенсивность окраски в ряду веществ: CuF2 (бесцветный) → CuCl2 (желтый) → CuBr2 (черный)?
Р е ш е н и е
В ряду ионов F– ® Cl– ® Br– увеличивается их радиус, а следовательно, растет и их поляризуемость. Чем больше поляризуемость, тем легче деформируется данный ион и меньше энергия, требуемая для этого процесса. Уменьшение энергии приводит к росту длины волны света (см. формулу (2)) и ее сдвигу в область видимой части спектра, то есть к увеличению интенсивности окраски вещества.
Пример 4. H2S при обычной температуре – газ, а вода – жидкость. Чем можно объяснить это различие в физических свойствах?
Р е ш е н и е
Кислород – более ЭО элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода. Разрыв этих связей требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Пример 5 . Ниже приведены Ткип (в К) благородных газов:
Не Nе Ar Kr Xe Rn
4,3 27,2 87,3 119,9 165,0 211,2
Чем объясняется повышение Ткип в данном ряду?
Р е ш е н и е
С ростом порядкового номера благородных газов увеличиваются размеры их атомов при сохранении аналогичной структуры внешнего электронного слоя атома. Поэтому поляризуемость атомов возрастает, вследствие чего возрастают и силы межмолекулярного взаимодействия между ними. Отрыв атомов друг от друга, происходящий при переходе вещества из жидкого состояния в газообразное, требует все большей затраты энергии. Это и приводит к повышению температуры кипения.
Список литературы
1. Коровин Н.В. Общая химия. М.: Высш. шк., 1998.
2. Павлов Н.Н. Общая и неорганическая химия: Учеб. для вузов. М.: ООО «Дрофа», 2002.
3. Общая химия в формулах, определениях, схемах / И.Е. Шиманович,
М.Л. Павлович, В.Ф. Тикавый, П.М. Малашко; Под ред. В.Ф. Тикавого. Минск: Унiверсiтэцкае, 1996.
4. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. М.: Изд-во «Астрель», 2004.
5. Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии. М.: Высш. шк., 1991.
6. Глинка Н.Л. Задачи и упражнения по общей химии. Л.: Химия, 1988.
7. Задачи и упражнения по общей химии / Под ред. Н.В. Коровина. М.: Высш. шк., 2003.
8. Рабинович В.А., Хавин З.Я. Краткий химический справочник. Л.: Высш. шк., 1991.
Дата добавления: 2018-11-26; просмотров: 616;











