Классификация твердых тел. Типы связей
До сих пор мы рассматривали твердое тело как систему, состоящую из дискретных частиц (атомов, ионов, молекул), образующих идеальную трехмерную периодическую структуру, и главное внимание уделяли закономерностям строения и симметрии кристаллических решеток. При этом мы ничего не говорили о силах, которые удерживают частицы вместе около положения их равновесия. Силы, удерживающие частицы в кристалле, имеют ту же природу, что и межатомные силы, которые обусловливают образование сложных молекул. Этими силами, как сейчас точно установлено, являются, в основном, силы электростатического притяжения между противоположно заряженными частицами (электронами и ядрами) и силы отталкивания между одноименно заряженными частицами (электронами и электронами, ядрами и ядрами).
Оценки потенциалов взаимодействия между частицами в кристалле показывают, что магнитные силы здесь весьма малы, а гравитационными силами вообще можно пренебречь. Таким образом, характер сил межатомного взаимодействия в первую очередь определяется строением электронных оболочек взаимодействующих атомов.
Характер межатомных сил иногда кладут в основу классификации твердых тел. Согласно этой классификации все твердые тела разделяют на четыре типа:металлические, ковалентные, ионные и молекулярные кристаллы.
Кристаллы неорганических веществ с водородной связью(которая по своему характеру является, в основном, ионной) часто выделяют в отдельный тип. Водородная связьобусловлена электростатическим притяжением между атомом водорода и каким-либо сильно электроотрицательным атомом (О, Р, N, Сl и др.). Классическим примером таких веществ является вода в жидком или твердом состоянии. Из-за недостатка места мы не будем более подробно останавливаться на этом типе связи и отошлем читателя к более фундаментальным трудам по физике твердого тела.
Заметим, что не существует однозначного способа классификации твердых тел. Так, все твердые тела можно классифицировать по свойствам симметрии их кристаллических структур, по электрическим свойствам. В соответствии с последней классификацией твердые тела, как это будет показано в гл. 4, делятся напроводники и изоляторы. Типичными проводниками электричества являются металлы (Аg, Си, Аu и др.), а изоляторами — ионные кристаллы.
Между металлами и изоляторами располагаются полуметаллы (Вi, Sb) и полупроводники (Si, Ge,). Полупроводники при низких температурах ведут себя как изоляторы.Полуметаллы, подобно металлу, проводят ток, хотя концентрация электронов проводимости в них примерно в 104 раз меньше, чем в металлах. Такое различие обусловлено особенностями электронной структуры.
В настоящей главе примем классификацию твердых тел, основанную на характере межатомных сил взаимодействия, который, как говорилось выше, определяется строением электронных оболочек взаимодействующих атомов.
Как правило, в межатомных связях у большинства элементов принимают участие все внешние валентные электроны. У Сu, Аg, Аu, Еu, Vb, Аm вследствие сравнительно небольшой энергии связи электронов заполненных d10-, f7- и f14- оболочек в межатомных связях могут дополнительно участвовать один-два электрона этих оболочек. Существует ряд элементов, имеющих большое число валентных электронов во внешней оболочке, но из-за их высоких энергий связи с атомом не все валентные электроны могут участвовать в межатомных связях (О, F, Fe, Со, Ni и др.).
Число валентных электронов, способных участвовать в межатомных связях, периодически изменяется с возрастанием атомного номера z, что является следствием периодического закона Менделеева, в соответствии с которым все физико-химические свойства должны изменяться периодически с ростом атомного номера.
При взаимодействии атомов одного сорта с атомами другого сорта характер химической связи определяется их способностью захватывать или отдавать валентный электрон. Эта способность характеризуется, так называемой электроотрицательностью атомов - X.
По существу, электроотрицательность — это параметр, выражающий тенденцию атома притягивать к себе электроны в конкретном твердом теле. Электроотрицательность — относительная мера взаимодействия атомов, она не является строго физической величиной, поскольку она не постоянна и зависит от природы другого атома, с которым химически связан данный атом.
Один и тот же атом в химической связи иногда одновременно может выступать и как электроположительный, и как электроотрицательный. Электроотрицательность очень слабо зависит от типа связи и от конкретных особенностей кристаллической структуры, что делает ее некоторым объективным параметром атомов, который полезен при обсуждении свойств твердых тел.
Таким образом, в левой части таблицы Менделеева располагаются элементы с наиболее сильно выраженными металлическими свойствами (металлы), а в правой — элементы с наиболее сильно выраженными неметаллическими свойствами (металлоиды).
Разделение химически активных элементов на металлы и металлоиды позволяет ввести три основных типа связи: металлическая, ковалентная и ионная. Связь между сильно электроположительными металлами и электроотрицательными неметаллами трактуется как ионная связь. Так как она осуществляется между противоположно заряженными ионами, то ее называют—по полярности ионов — гетерополярной. К гомополярнымотносят металлическую и ковалентную связи. Металлическая связь реализуется между металлами и металлами, а ковалентная — между неметаллами и неметаллами или металлоидами. Названные типы связей являются предельными случаями химического взаимодействия. В реальной ситуации ковалентные связи в чистом виде редко реализуются и имеют в какой-то мере частично ионный характер. Соединений, близких к идеально ионным, также чрезвычайно мало.
Энергия связи
Проблема связи атомов в твердых телах из-за одинаковой природы сил взаимодействия между атомами аналогична проблеме сил связи атомов в молекулах. Силы связи в молекулах и твердых телах имеют много общего. Ответ о силах связи в твердых телах представляет собой обобщение ответа, полученного для молекул. Поэтому для количественной оценки энергии связи атомов в твердых телах сначала рассмотрим силы, которые удерживают атомы вместе в двухатомной молекуле.
Допустим, что имеются два атома А и В. Если атомы находятся далеко друг от друга, то они ведут себя как свободные.Энергия такой системы, состоящей из двух изолированных атомов, равна сумме энергий этих атомов, которую произвольно можно принять за нуль. Атомы не взаимодействуют друг с другом до техпор, пока расстояние
rмежду ними велико по сравнению с (rA+rB), rAи rB — радиусы атомов А и В. Если при уменьшении расстояния между атомами энергия системы понижается по сравнению с суммарной энергией изолированных атомов, то между атомами возникает сила притяжения, чему соответствует уменьшение потенциальной энергии системы U(r).
При некотором расстоянии r=r0энергия U (r) достигает минимального значения, которое соответствует силе:
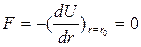 (3.1)
(3.1)
Этот минимум обязательно существует; в противном случае вообще не смогла бы образоваться молекула с конечным расстоянием между ядрами.
При дальнейшем сближении атомов между ними начинают действовать силы отталкивания, быстро возрастающие с уменьшением r, что сопровождается также возрастанием потенциальной энергии U(r).
Смена притяжения отталкиванием может быть приближенно описана путем представления полной потенциальной энергии взаимодействия в виде суммы двух членов, из которых один (отрицательный) соответствует энергии сил притяжения, а другой (положительный) — энергии сил отталкивания:
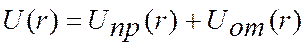 (3.2)
(3.2)

На рис. 3.1 схематически изображены кривые этих потенциалов и суммарная кривая, соответствующая полной потенциальной энергии взаимодействия. При r=r0, соответствующем минимуму энергии системы, силы притяжения уравновешиваются силами отталкивания (Fпр—Fот=0), при этом образуется молекула AB с наиболее стабильной конфигурацией, в которой ядра атомов совершают колебания с собственной частотой.
Глубина минимума U0равна энергии связи атомов в молекуле.Энергия связи, или энергия сцепления, равна разности потенциальной энергии системы в начальном (1) и конечном (2) состояниях.
За начальное состояниесистемы обычно принимают такое состояние, когда частицы (атомы, молекула, ионы) находятся друг от друга на достаточно больших расстояниях и не взаимодействуют между собой, так что можно положить U1=0.
Конечное состояние отвечает равновесному расположению частиц системы при Т=0 К. Исходя из сказанного, энергию связи можно представить в виде
U0= - U2
Для оценки энергии связи, как это видно из формулы (3.2), необходимо знать хотя бы в общем виде зависимости потенциалов притяжения Uпр и отталкивания Uот от расстояния rмежду взаимодействующими атомами. Конкретный вид этих зависимостей определяется природой взаимодействующих атомов.
Легко видеть, что потенциал сил притяжения, исходя из их электростатического характера, можно представить степенной функцией
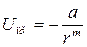 , (3.3)
, (3.3)
где a и m — положительные константы
При т=1 потенциал (3.3) соответствует обычному кулоновскому взаимодействию между противоположно заряженными ионами, а при m = 6, как мы увидим ниже, — потенциалу притяжения при взаимодействии между атомами инертных газов.
Для потенциала сил отталкивания, который обусловлен прежде всего отталкиванием ядер взаимодействующих атомов и зависит от экранировки ядер окружающими их электронами, Борн и Ланде, исходя из классических представлений-, получили выражение
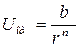 (3.4)
(3.4)
где b, n >0 — постоянные. При выводе формулы для потенциала сил отталкивания Борном и Ланде была выбрана статическая модель атома, в которой электроны в 8-электронной оболочке размещены по вершинам куба. Ясно, что при взаимодействии таких атомов потенциал сил отталкивания должен зависеть от их взаимной ориентации, однако этого никогда не наблюдается в эксперименте.
При выводе формул для энергии связи мы будем пользоваться для потенциала сил отталкивания выражением (3.4), поскольку его использование значительно упрощает расчеты.
Теперь запишем выражение для полной потенциальной энергии взаимодействия двух атомов в виде
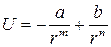 (3.5)
(3.5)
Для того чтобы функция Uв выражении (3.5) имела минимум, необходимо, чтобы показатель степени потенциала отталкивания был больше показателя степени потенциала притяжения, т. е. чтобы выполнялось условие: n>т.
Зависимость энергии связи в кристаллах от межатомного расстояния r, так же как и в молекулах, определяется двумя главными членами: 1) притяжением атомов, обусловленным взаимодействием валентных электронов, и 2) кулоновским отталкиванием внутренних электронных оболочек атомных остовов и отталкиванием ядер. Для устойчивого равновесного состоянияобязательно наличие минимума энергии на суммарной кривой энергий притяжения и отталкивания, который соответствует определенной стабильной конфигурации в расположении атомов кристаллической решетки.
Энергия связи (или энергия сцепления) кристалла представляет собой энергию, которая необходима для разделения тела на составные части. В зависимости от типа твердого тела составными частями могут быть молекулы и атомы в молекулярных кристаллах, атомы в ковалентных и металлических кристаллах, положительно и отрицательно заряженные ионы в ионных кристаллах.
При расчете энергии сцепления молекулярных и ионных кристаллов в силу того, что конфигурация электронов в этих кристаллах не слишком сильно отличается от их конфигурации в изолированных атомах или ионах, обычно ограничиваются вычислением классической потенциальной энергии системы сферически симметричных частиц, образующих определенную кристаллическую структуру. Считается, что силы, действующие между атомами или ионами, являются центральными, т. е. полная потенциальная энергия системы зависит только лишь от расстояния между взаимодействующими частицами, которые локализованы в узлах решетки и кинетическая энергия которых пренебрежимо мала.
Оказывается, что даже при таких довольно-таки грубых приближениях теоретические оценки энергии связи приводят к достаточно хорошему согласию с экспериментом.
Дата добавления: 2021-02-19; просмотров: 792;











