Высокомолекулярные углеводы (полисахариды)
Высокомолекулярные углеводы представляют собой основ-ную составляющую органической материи в биосфере планеты. Они выступают в роли структурных компонентов клеток и тканей, энергетического резерва и защитных веществ.
К высокомолекулярным углеводам относятся целлюлоза, крахмал, гликоген, хитин, хитозан, инулин, камеди и пектиновые вещества.
Целлюлоза, или клетчатка, – самый распространенный орга-нический природный полимер, основа клеточных стенок растений. Мономер целлюлозы – циклическая β-глюкоза (рис. 15).

Рис. 15. Целлюлоза – линейный полисахарид
Целлюлоза является жесткоцепным полимерам. Ее макромо-лекулы не образуют спирали. Полимерные цепочки соединяются между собой водородными связями. Такое строение обусловли-вает склонность целлюлозы к образованию волокон. На основе целлюлозы получают искусственные полимеры: метилцеллюлозу, ацетилцеллюлозу, нитроцеллюлозу.
Крахмал накапливается в клубнях, плодах, семенах растений в качестве основного источника резервного питания. Мономеры крах-мала – циклическая α-глюкоза. Крахмал представляет собой смесь двух полимеров: амилозы и амилопектина. Макромолекулы амилозы (рис. 16) имеют степень полимеризации 200 ÷ 1000 и образуют спирали, обусловленные существованием водородных связей.

Рис. 16. Амилоза – линейный полисахарид
Амилопектин имеет разветвленное строение и содержит более 10000 структурных звеньев (рис. 17).
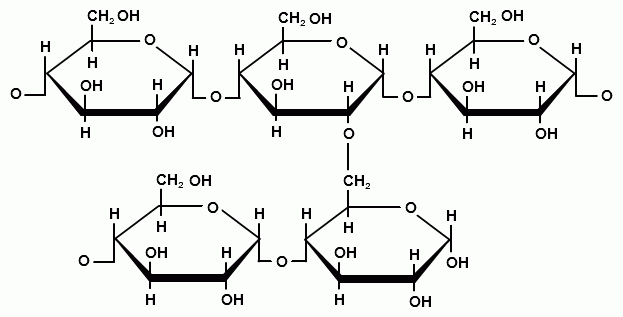
Рис. 17. Амилопектин – разветвленный полисахарид
При нагревании раствора крахмала образуется «клейстер» – коллоидный гель.
Углевод, образующий питательный резерв животных клеток, называется гликогеном. Он имеет химический состав, аналогичный крахмалу, и сильно разветвленную пространственную структуру. При дефиците в живом организме глюкозы гликоген под дей-ствием ферментов распадается и глюкоза поступает в кровь. Синтез и разложение гликогена регулируются с помощью гормонов и нервной системы.
Белки
К белкам (протеинам, полипептидам) относятся органические природные полимеры, образованные α-аминокислотами (рис. 18), которые соединены пептидной связью. Аминокислоты могут содержать в своем составе железо, серу, кобальт, фосфор. В состав белков входят остатки не более 22 α-аминокислот.
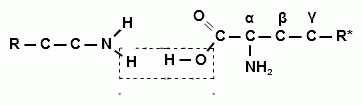
Рис. 18. Поликонденсация α-аминокислот с образованием пептидной связи
На поведение и биохимические свойства белков влияет как химический состав аминокислот, так и их сочетание в макро-молекулах. Разнообразие в химическом составе белков тесно свя-зано с многообразностью их функций.
Основные функции белков:
· транспортная, например гемоглобин;
· регуляторная или гормональная, например инсулин;
· каталитическая – ферменты;
· структурная, механическая, например коллаген;
· резервная – казеин;
· иммунологическая – иммуноглобулины.
Приведем некоторые примеры белков:
· гемоглобин – железосодержащий белок крови, способный обратимо связываться с кислородом. Функция гемоглобина – доставлять кислород к органам и тканям живых организмов;
· инсулин – гормон, вырабатываемый поджелудочной железой. Он оказывает влияние на обмен веществ практически во всех тканях. Основное действие инсулина – снижение концентрации глюкозы в крови;
· коллаген – основа соединительной ткани организма, обус-ловливающий ее прочность и эластичность;
· ферменты – природные катализаторы с их помощью ката-лизируются биохимические процессы в организме.
Молекулярная масса белков может достигать нескольких миллионов у.е. Одна из самых маленьких – молекула инсулина – состоит из 60 аминокислотных звеньев и весит 12000 у.е.
Макромолекулы имеют стереорегулярную структуру, что важно для проявления белками определенных биохимических свойств.
Существуют четыре уровня структурной организации белков:
· первичная структура – линейная последовательность α-ами-нокислотных звеньев (рис. 19);
· вторичные структуры: α-спираль, β-структура (складчатый лист). Вторичные структуры образуются за счет водородных свя-
зей между звеньями одной цепи (α-спираль) и межмолекулярных (β-структура) (рис. 20);
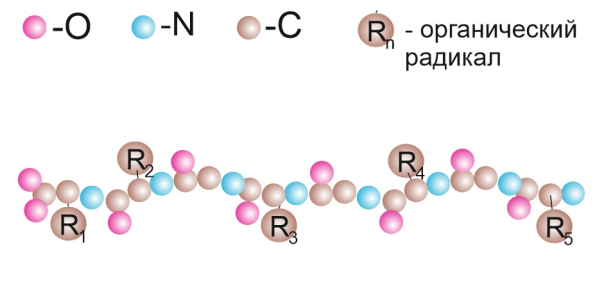
Рис. 19. Первичная структура белка
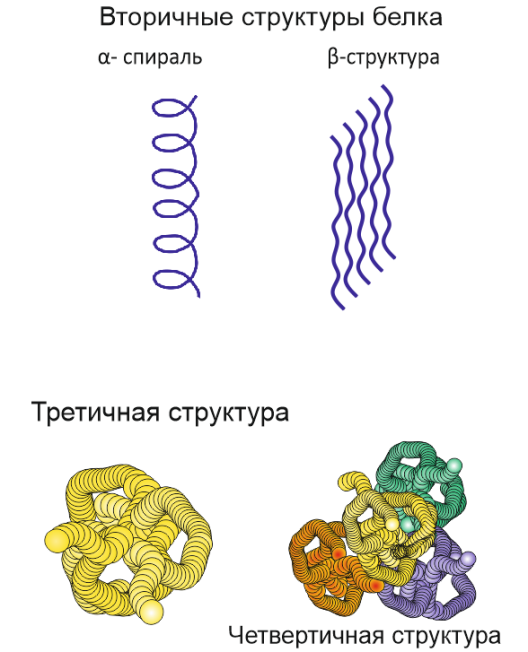
Рис. 20. Уровни структурной организации белков
· третичная структура – способ укладки макромолекул вто-ричной структуры в пространстве. α-спирали чаще образуют эллипсовидные глобулы (глобулярные белки), а β-структуры – вытянутые (фибриллярные белки) (рис. 20). Третичные структуры закрепляются как силами Ван-дер-Ваальса, так и ковалентными дисульфидными мостиками (–S–S–);
· четвертичная структура – способ укладки нескольких макромолекул белка третичной структуры в пространстве (рис. 20).
В природе существует около 1012 всевозможных белков, обеспечивающих жизнь различных организмов, от вирусов до человека. Каждому виду присущ свой набор белков. Последовательность α-аминокислот в полипептидной цепи предопределяет информация, содержащаяся в ДНК живых организмов.
Дата добавления: 2020-10-25; просмотров: 772;











