Методические указания
1. Разбор основных правил отбора и пересылки проб мяса и мясных
продуктов для исследования
Для проведения микробиологических исследований мяса с целью выделения и идентификации микроорганизмов отбирают:
· мышечную ткань;
· лимфатические узлы;
· паренхиматозные органы.
Для бактериологических исследований скоропортящихся мясных продуктов (студни, зельцы, ливерные колбасы, кровяные изделия, паштеты) пробы отбирают с помощью стерильного ножа или других стерильных инструментов. Из выбранных единиц продукции берут разовые пробы и из них составляют общую пробу, а именно:
• от колбасных изделий - не менее двух разовых проб, ломтики по 15 см толщиной от края батона;
• от сосисок и сарделек - из разных мест, не нарушая целостности единиц продукции;
• от языков - с двух единиц продукции;
• от продуктов из свинины, баранины, говядины и мяса других видов убойных животных и птиц - пробы по всей толщине, ломтики шириной не менее 10 см от двух единиц продукции;
• от окороков - срез по всей толщине, отбирают образцы шириной не менее 10 см;
• от изделий без оболочки (студней, паштетов и др.) - разовые пробы не менее, чем от трёх единиц изделий массой 200-250 г каждая.
Отбор проводят стерильными приспособлениями в стерильную посуду с соблюдением правил асептики и антисептики. Образцы массой не менее 200 г упаковывают в пергамент, целлюлозную или пищевую полиэтиленовую плёнку и помещают в бумажный пакет. Затем пробы пломбируют и снабжают сопроводительной документацией, в которой указывают дату и время отбора пробы, номер и размер партии, номер образца, наименование и сорт продукта, объём необходимых исследований, должность и фамилию лица, проводившего отбор проб, и направившего должностного лица. Транспортируют образцы в кратчайший срок, при этом целесообразно использовать сумки-холодильники.
К исследованиям приступают не позднее, чем через 4 ч. Если это невозможно, отмечают причину задержки, а пробы хранят до анализа при температуре +4 °С (замороженные продукты - не выше -2 °С).
2. Проведение микроскопического исследование мяса путем определения
количества бактерий в мазках-отпечатках
Микроскопическое исследование мяса основано на определении
количества бактерий в мазках-отпечатках и степени распада мышечной ткани. Поверхность исследуемой мышечной ткани стерилизуют раскалённым шпателем или обжигают тампоном, смоченным в спирте. Вырезают стерильными ножницами кусочки размером 2,0x1,5x2,5 см поверхностями срезов прикладывают к предметному стеклу (по три отпечатка на двух предметных стёклах). Мазки-отпечатки высушивают на воздухе, фиксируют, окрашивают по Граму и микроскопируют (на одном предметном стекле исследуют 25 полей зрения).
| Стафилококк Staphylococcus | Микрофлора мазка-отпечатка Окраска по Граму | Кишечная палочка Escherichia coli |
3. Микробиологическое исследование мяса и мясных продуктов на наличие санитарно-показательных и патогенных микроорганизмов
3.1. Подготовка проб к исследованию
Каждый образец (мышцы, лимфатические узлы, паренхиматозные органы) перед посевом освобождают от видимой жировой и соединительной ткани, погружают на 2-3 мин в этиловый спирт-ректификат и два раза обжигают с поверхности. Затем стерильными ножницами из каждого образца (с различной глубины) вырезают кусочки размерами 2,0 х1,5м2, 5 см. Лимфатические узлы разрезают пополам. Все вырезанные кусочки измельчают стерильными ножницами.
Для последующих исследований готовят две пробы по 15 г каждая. Одна проба состоит из кусочков мышц и лимфатических узлов, а вторая - из кусочков паренхиматозных органов (печени, почек, селезёнки). Каждую пробу помещают в стерильный стакан (колбу) гомогенизатора, добавляют по 1,5 см3 0,9% раствора натрия хлорида и готовят взвеси в течение 2-5 мин. Полученные взвеси отстаивают 10 мин, и для исследований берут надосадочную жидкость.
При бактериологическом исследовании мясных продуктов в лаборатории из каждой общей пробы готовят средние образцы массой примерно 20 г. Навески помещают в стерильные стаканы (колбы), добавляют 0,9% раствор натрия хлорида и гомогенизируют не более 2,5 мин. При отсутствии гомогенизатора допустимо приготовление взвеси растиранием 20 г продукта в стерильной фарфоровой ступке с 2-3 стерильного кварцевого песка, постепенно приливая 80 см3 стерильного 0,9% раствора натрия хлорида или стерильной воды. Приготовленные взвеси отстаивают в течение 15 мин и для дальнейших исследований берут надосадочную жидкость, 1 см3 которой содержит 4,2 г продукта.
3.2. Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов
Количество МАМ и ФАнМ в 1 г (см3) продукта определяют по числу колоний мезофильных аэробных и факультативно-анаэробных микроорганизмов, выросших на поверхности и в глубине плотных питательных сред при температуре 30±1 °С в течение 72 ч.
Для определения количества микроорганизмов в стерильные чашки Петри вносят по 1 см3 разных разведений из каждой пробы, заливая их 10-15 см3 расплавленного и охлаждённого до температуры 45 °С агара. Разведения выбирают в соответствии со стандартом (техническими условиями) на данный продукт.
Для подсчёта колоний используют лупу с 4-10-кратным увеличением или счётчик колоний. Для удобства каждую подсчитанную колонию отмечают со стороны дна маркером по стеклу. При значительном росте микробов дно чашки делят карандашом на секторы, подсчитывая число колоний отдельно в каждом секторе, а затем полученные числа складывают и умножают на степень разведения.
Количество микроорганизмов (N) в 1 г (см3) пробы вычисляют, как средневзвешенное значение из подсчётов на двух последовательных разведениях по формуле:
N=ΣC/V×(n1+0,1n2)×d,
где ΣС - сумма колоний, подсчитанных на всех чашках в двух последовательных разведениях, из которых хотя бы одна чашка содержит не менее 15 колоний;
V- объём посевного материала, внесённого в каждую чашку, см3;
n1 - количество отобранных для подсчёта чашек в первом разведении;
n2 - количество отобранных для подсчёта чашек во втором разведении;
d- коэффициент разбавления, соответствующий первому разведению.
Результат вычисления округляют до двух значащих цифр. Для получения достоверных результатов при подсчёте необходимо, чтобы хотя бы в одной чашке содержалось не менее 15 колоний. В противном случае указывают приближённое количество микроорганизмов в 1 см3, рассчитанное по среднему арифметическому колоний, выросших на двух чашках.
3.3. Определение количества бактерий группы кишечных палочек
Навеску анализируемого продукта (1,0-0,001 г по СанПиН 2.3.2.1078-01), в которой не должно быть БГКП, смешивают с 9 частями жидкой питательной среды (чаще всего используют среду Кесслер, содержащую в своём составе генцианвиолет, угнетающий рост грамположительных бактерий). Из пробирок с забродившей средой (помутнение, наличие газа в поплавках) делают посевы на чашки со средой Эндо. Посевы выдерживают в термостате при температуре 37 °С в течение 18-24 ч. Из колоний, типичных для БГКП (красных, с металлическим блеском, розовых, бледно-розовых), готовят мазки и окрашивают их по Граму.
3.4. Методы обнаружения сальмонелл
Пробу мяса или мясного продукта дважды пропускают через мясорубку, перемешивают, взвешивают 25 г, затем помещают в стерильную банку смесителя с 225 см3 буферной пептонной водой и гомогенизируют. Далее в асептических условиях переносят содержимое смесительной банки в стерильную колбу вместимостью 500 см3. Колбу выдерживают в термостате при температуре (37±1) °С не менее 16 и не более 20 ч, после чего приступают к анализу.
Выявление сальмонелл проводится в четыре последовательных этапа: первичный (прямой) посев, обогащение, посев со среды обогащения и подтверждение.
Первичный посев производится путем посева взвеси исследуемого материала на плотные элективные среды. Эти среды выдерживают в термостате при температуре 37 °С и исследуют на присутствие колоний, которые являются типичными или подозрительными на сальмонеллы.
На элективных средах сальмонеллы растут, образуя характерные колонии:
- на фуксин-сульфитном агаре (агаре Эндо) сальмонеллы растут в виде круглых, бесцветных или слегка розоватых прозрачных, или полупрозрачных колоний;
- на эозин-метиленовом синем агаре (агаре Левина) сальмонеллы растут в виде прозрачных, бледных, нежно-розовых или розовато-фиолетовых колоний.
Обогащение проводят путем посева на жидкие селективные среды (среды Мюллера, Кауфмана и Киллиана, селенитовый Ф-бульона и хлористо-магниевая среды "М"). Эти среды выдерживают в термостате при температуре 37 °С. На селенитовом бульоне лучшей температурой для накопления сальмонелл является 43 °С.
В случае отсутствия роста бактерий сальмонелл при первичном (прямом) посеве на элективных средах, через 12-24 ч проводят высев на селективные среды со сред обогащения. Предварительно содержимое флаконов перед пересевом тщательно перемешивают и высевают штрихом петлей диаметром 2,5-3 мм на чашку с висмут-сульфитным агаром, бактоагаром Плоскирева или агаром Эндо. Посевы помещают в термостат на 18-24 ч при температуре 37 °С, а посевы на висмут-сульфитном агаре - на 48 ч.
На селективных средах сальмонеллы растут, образуя характерные колонии:
- на бактоагаре Плоскирева сальмонеллы растут в виде бесцветных колоний, но колонии более плотные и несколько меньшего размера, чем на среде Эндо;
- на висмут-сульфитном агаре сальмонеллы растут в виде черных или коричневых колоний с характерным металлическим блеском.
Далее проводят подтверждение - пересев подозрительных на сальмонеллы колоний и определение их биохимических и серологических характеристик. В соответствии с нормативами санитарно-биологических показателей для мяса и мясных продуктов содержание сальмонелл в 25 г исследованного продукта не допустимо.
3.5. Методы выявления и определения количества Staphylococcus aureus в колбасных изделиях и продуктах из мяса
Сущность метода заключается в определении морфологии, характера роста на питательных средах и в способности отдельных стафилококков продуцировать лецитиназу и коагулировать цитратную плазму крови кролика под воздействием фермента коагулазы.
Методика проведения анализа заключается в следующем. Из разведения анализируемой взвеси продукта (1:10) проводят посевы на молочно-солевой агар, содержащий 65 г/дм3 хлористого натрия, для выявления пигмента или желточно-солевой агар, содержащий 65 г/дм3 хлористого натрия, для выявления лецитиназной активности. Взвесь наносят на поверхность агара в количестве 0,2 см3 и равномерно растирают по всей поверхности агаровой среды. Посевы термостатируют в течение 24 ч при температуре 37 °С и 24 ч выдерживают при комнатной температуре.
На поверхности питательной среды колонии стафилококка имеют вид плоских или слегка выпуклых блестящих колоний с ровным краем. При этом на молочно-солевом агаре лучше выявляется пигмент (эмалево-белый или золотистый), а на желточно-солевом агаре колонии стафилококков могут образовывать «радужный венчик», что является одним из признаков их патогенности.
Из подозрительных колоний готовят препараты, которые окрашивают по Граму. При наличии стафилококков в препарате обнаруживаются грамположительные мелкие кокки, располагающиеся неправильными гроздьями.
Для подтверждения признаков патогенности стафилококков ставят реакцию плазмокоагуляции. В прибор с 0,5 см3 цитратной плазмы крови кролика, разведенной физиологическим раствором в соотношении 1:4, вносят петлю чистой суточной культуры стафилококка и ставят в термостат при температуре 37 °С. Реакцию плазмокоагуляции учитывают через 3-4 ч (не встряхивая пробирку) и оставляют в термостате на сутки для окончательного учета через 24 ч.
Тест на коагулазу считают положительным, если культура показала, по крайней мере, 3+ - оценку коагулазной реакции, отмеченной на рисунке 1. Реакцию на 1+ или 2+ оценивают как промежуточную.
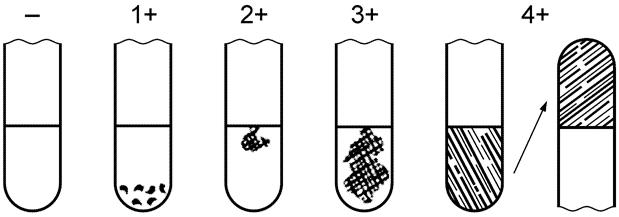
Рис. 1.Результаты коагулазного теста
- отрицательная оценка: не отмечено образования фибрина;
1+ положительная оценка: небольшие несформировавшиеся комочки;
2+ положительная оценка: небольшой сформировавшийся комок;
3+ положительная оценка: большой сформировавшийся комок;
4+ все содержимое пробирки скоагулировано и не меняет своего положения при переворачивании пробирки.
Для определения количества стафилококков учитывают колонии стафилококков, давшие положительную реакцию плазмокоагуляции.
Количество S. aureus в 1 см3 или 1 г продукта определяют исходя из количества коагулазоположительных стафилококков, принадлежность которых к S. aureus подтверждена по образованию ацетоина, определению ферментации в аэробных условиях мальтозы и, при необходимости, определению термостабильной нуклеазы и гемолитической активности. При расчете на 1 г продукта количество подсчитанных колоний умножают на степень разведения и делят на количество посевного материала.
3.6. Определение количества сульфитредуцирующих клостридий
Для определения количества этих бактерий в продукте используют количественный посев в глубину плотной питательной среды
Сущность метода заключается в специфическом росте сульфитвосстанавливающих клостридий в среде Вильсон-Блера, на которой в результате восстановления сернистокислого натрия в сернокислый натрий происходит взаимодействие с хлористым железом и образуется почернение среды за счет сернистого железа.
В пробирки, содержащие по 9 см3 расплавленной и охлажденной до температуры 45 °С среды Вильсон-Блера, вносят стерильной пипеткой по 1 см3 десятикратных разведений (от 10-1 до 10-7) взвеси испытуемого продукта. Посевной материал и среду тщательно перемешивают. Посевы помещают в термостат с температурой 46 °С на 8-12 ч или 37 °С на 20 ч. Появление в среде черных колоний или почернение всей среды указывает на присутствие сульфит-восстанавливающих клостридий.
Почернение среды Вильсон-Блера могут вызвать многие энтеробактерии. Для подтверждения роста сульфитвосстанавливающих клостридий используют пересев в пробирки со средой Китта-Тароцци, предварительно прогретой в течение 25 мин в кипящей водяной бане и быстро охлажденной до 45 °С. Термостатирование посевов проводят при (37±0,5) °С, ежедневно в течение 5 сут, проверяя в них помутнение среды, выделение газа, появление постороннего запаха, иногда разложение кусочков печени. Сразу после появления признаков роста готовят микроскопический препарат. Материал для этого берут пастеровской пипеткой со дна пробирки. При микроскопировании отмечают грамположительные палочки, образующие овальные споры.
У спорообразующих грамположительных микроорганизмов выявляют каталазную активность с помощью раствора перекиси водорода 30 г/дм3. Отсутствие пузырьков газа при добавлении к капле культуральной жидкости такого же количества перекиси водорода позволяет считать, что в посевах присутствуют микроорганизмы из рода клостридий.
В случае отсутствия спор в микроскопическом препарате положительной пробы на каталазу, присутствия в посевах смешанной микрофлоры, 1-2 капли накопительной среды переносят в стерильную чашку Петри, заливают расплавленной и охлажденной до 45 °С средой Вильсон-Блера. Застывшую поверхность плотной среды заливают холодным агаром. Посевы термостатируют 24-48 ч при (37±0,5) °С. Появление в нижнем слое агара черных или коричневых колоний свидетельствует о присутствии в посевах сульфитвосстанавливающих клостридий.
За положительный титр клостридий (сульфит-восстановителей) принимают то максимальное разведение суспензий, в посеве которого произошло почернение среды. Например, если характерные изменения наблюдаются в пробирках с разведением 10-2, то считают, что в исследуемом продукте будет 10 (или 1×101) клеток в 1 г; если характерные изменения наблюдаются в пробирках с разведением 10-2, то считают, что в исследуемом продукте - 100 (или 1×102) микробных клеток в 1 г.
3.7. Методы выявления Listeria monocytogenes
Из изменённых органов и тканей готовят мазки-отпечатки, которые красят по Граму и микроскопируют. В мазках листерии имеют вид мелких, часто полиморфных грамположительных палочек, расположенных одиночно или под углом в виде римской цифры V и в виде частокола. При посеве материала учитывают очаговую локализацию возбудителя в органах и тканях и используют изменённые участки, из которых готовят суспензию на 0,9% растворе натрия хлорида в соотношении 1:5 и из неё делают посевы, которые инкубируют в термостате при температуре 37 °С и ежедневно просматривают в первые 3-4 сут. При отсутствии роста наблюдение за посевами проводят в течение 2 нед.
На МПА листерии растут в виде мелких, круглых, прозрачных колоний при просмотре в проходящем свете (похожи на колонии возбудителя рожи). Через несколько дней колонии мутнеют. В мазке из агаровой культуры листерии выглядят как прямые короткие (0,3- 0,5x1-2 мкм) овоидные палочки, иногда - почти как кокки, располагающиеся одиночно или кучками. На МПА с 1% глюкозы и 2% глицерина, а также на печёночных средах рост напоминает колонии БГКП. На кровяном агаре листерии вызывают β-гемолиз.
Листерии вызывают равномерное помутнение МПБ, при встряхивании которого можно наблюдать муаровые волны, но более грубые, чем при росте рожистых бактерий. На 8-10 сут инкубации образуется осадок, который при встряхивании поднимается вверх в виде косички. В молодых культурах (6-24 ч) листерии подвижны; подвижность их лучше видна после культивирования при комнатной температуре; они сбраживают салицин, глюкозу, лактозу и глицерин с образованием кислоты без газа, не ферментируют маннит, дульцит; не разжижают желатин, не коагулируют молоко, редуцируют метиленовую синь.
Для дифференциации листерии от возбудителя рожи свиней проводят каталазную пробу. В пробирку с исследуемой культурой (растущей 12-24 ч на МПБ) прибавляют 1 см3 10% раствора перекиси водорода. При наличии каталазы жидкость вспенивается, бактерии рожи свиней каталазу не образуют.
Надёжным тестом для отличия листерии от рожистой палочки служит глазная проба: в конъюнктивальный мешок морской свинки вводят 1-2 капли смыва 0,9% раствором натрия хлорида суточной культуры, выросшей на МПА, и тщательно втирают в слизистую оболочку века. Обычно через 24 ч появляется отек века, гиперемия, слезотечение; через 36-72 ч веки припухают, и из глаза выделяется гнойный экссудат.
Для ускоренной дифференциации возбудителя листериоза от возбудителя рожи свиней используют индикаторные среды с лакмусом, нейтральротом в смеси с метиленовой синью, метилротом, конгоротом и амидо-чёрным. Листерии обесцвечивают среду с лакмусом и среду с нейтральротом в смеси с метиленовой синью до цвета МПБ в течение 3-6 ч, лишь у поверхности на границе с воздухом остаётся окрашенный ободок. При встряхивании цвет частично восстанавливается, поэтому посевы просматривают, не встряхивая пробирок. Среда с метилротом обесцвечивается листериями через 3-6 ч, но восстановление цвета среды не происходит. Обесцвечивание сред с конгоротом и с амидо-чёрным происходит в более поздние сроки - через 6-48 ч, после обесцвечивания среды исходный цвет не восстанавливается. Возбудитель рожи свиней не обесцвечивает ни одну из вышеуказанных сред с индикаторами.
Для серологической идентификации выделенных листерий применяют РА с поливалентной и групповыми листериозными сыворотками. Исследуемую культуру признают листериями при получении положительных результатов РА с листериозной сывороткой и отрицательной РА в контроле с 0,9% раствором натрия хлорида. Для идентификации возбудителя листериоза используют также листериозные бактериофаги (2А, 3А и 4А).
Контрольные вопросы
Как отбираются пробы мяса и мясных продуктов для микробиологических исследований?
Как осуществляется степень свежести мяса методом отпечатков?
Каким образом пробы мяса и мясных продуктов подготавливают к исследованиям?
Как определяют МАМ и ФАнМ?
Как определяют количество БГКП?
Какие этапы выявления сальмонелл вы знаете?
Что такое элективные и селективные питательные среды?
Какие характерные колонии образуют сальмонеллы на элективных средах?
Какие среды обогащения вы знаете?
Какие характерные колонии образуют сальмонеллы на селективных средах?
Что является ведущим свойством при установлении патогенности стафилококков?
В чем сущность реакции плазмокоагуляции?
Как оцениваются результаты коагулазного теста?
В чем сущность метода определения сульфитредуцирующих клостридий?
Что принимают за положительный титр клостридий?
Какие методы выявления листерий вы знаете?
Как проводится серологическая идентификация выделенных листерий?
Какие показания к отбору проб мяса вы знаете?
Как проводится оценка степени свежести мяса?
Какие санитарно-показательные микроорганизмы продуктов питания вы знаете?
Дата добавления: 2021-02-19; просмотров: 514;











