Термодинамика образования растворов биполимеров
Растворение высокомолекулярных веществ принято рассматривать как процесс смешения двух жидкостей. Аналогия между растворением высокомолекулярного вещества и смешением двух жидкостей не является формальной, а отвечает самому существу явления. Так, ограниченное набухание высокомолекулярного вещества соответствует процессу ограниченного смешения, а неограниченное набухание, переходящее в растворение, - процессу неограниченного смешения.
Самопроизвольное растворение ВМС при постоянном давлении должно сопровождаться уменьшением изобарно-изотермического потенциала (свободной энергии при постоянном давлении). Согласно второму закону термодинамики изменение изобарно-изотермического потенциала системы составляет: ΔG = ΔН - TΔS.
Очевидно, для того чтобы произошло самопроизвольное растворение полимера, ΔG должно иметь отрицательное значение. Это может быть в двух случаях:
1) при условии ΔН < 0, которое соблюдается, если при растворении выделяется теплота, так как изменение энтальпии (или внутренней энергии) равно интегральной теплоте растворения с обратным знаком. Такое условие часто соблюдается на практике, например, при растворении полярных полимеров в полярных растворителях. Положительный тепловой эффект при растворении объясняется тем, что теплота сольватации макромолекул больше теплоты собственно растворения, а как известно, общий тепловой эффект растворения равен алгебраической сумме теплот сольватации и собственно растворения;
2) при условии ΔS > 0, которое всегда осуществляется на практике при растворении, так как энтропия смешения всегда положительна. Энтропия смешения ВМС с растворителем, рассчитанная на весовую долю вещества, лежит между значениями энтропии растворения низкомолекулярных веществ и типичных коллоидных систем.
Поэтому относительная роль энтропийного фактора при растворении ВМС меньше, чем при растворении низкомолекулярных веществ, а энтальпийный фактор (сольватация) имеет относительно большое значение. Вместе с тем, поскольку в рассматриваемом случае энтропийный член не равен нулю, а может иметь сравнительно большие значения, некоторые полимеры способны растворяться с поглощением, а не с выделением тепла, т.е. при ΔН > 0. Это обусловлено тем, что в таких случаях TΔS > ΔН и, следовательно, ΔG < 0.
При повышении температуры значение энтропийного фактора возрастает. Таким образом, для всякого ВМС и растворителя должна существовать критическая температура растворения Tкрит, выше которой наблюдается их смешение во всех отношениях. Теоретически такая критическая температура должна существовать для любой комбинации
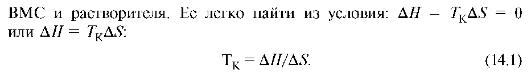
Еще 70 лет тому назад существовали две теории растворов полимеров. Согласно одной из них (мицеллярная теория, развитая Майером и Марком), макромолекулы находятся в растворе в виде мицелл, согласно второй - достаточно разбавленные растворы ВМС содержат отдельные, не связанные друг с другом молекулы (молекулярная теория).
В настоящее время мицеллярная теория потеряла свое значение. Как показали исследования, ВМС в подходящих растворителях само-
произвольно диспергируются до отдельных молекул. Молекулярная теория находит подтверждение в ряде фактов.
1. Определение молекулярных масс в разбавленных растворах полимеров однозначно показало отсутствие в таких растворах мицелл.
2. Растворение высокомолекулярного вещества, как и растворение низкомолекулярного, идет самопроизвольно, часто с выделением тепла. При диспергировании же вещества до коллоидного состояния требуется затрата энергии на преодолении межмолекулярных сил.
Растворы полимеров термодинамически устойчивы и при соответствующих предосторожностях могут храниться достаточно долго. Коллоидные растворы, наоборот, термодинамически неустойчивы, и в них происходит коагуляция.
Растворение полимеров не требует присутствия в системе стабилизатора. Лиофобные же золи не могут быть получены без специального стабилизатора, придающего системе агрегативную устойчивость.
Это все относится к разбавленным растворам ВМС. В концентрированных растворах макромолекулы могут взаимодействовать и образовывать так называемые ассоциаты. С увеличением концентрации растворов ВМС или с понижением их температуры размер и длительность существования ассоциатов увеличиваются. Это может привести к тому, что ассоциаты можно будет рассматривать как новую фазу.
На образование дисперсий оказывает влияние и растворитель. В растворителях, полярность которых соответствует полярности ВМС, происходит истинное растворение с образованием молекулярных растворов (агар-агар и желатин в воде или каучук в неполярном растворителе). При несоответствии полярности растворителя и ВМС образуются золи или дисперсии.
Истинному растворению полимеров часто предшествует процесс набухания. Он заключается в увеличении объема и массы полимера за счет поглощения им какого-то количества растворителя. При контакте полимера с растворителем начинается взаимная диффузия молекул растворителя в полимер, а макромолекул полимера - в растворитель. Однако скорость диффузии будет различаться в той же пропорции, что и размеры, а также подвижности диффундирующих частиц. Резкое различие в подвижностях молекул растворителя и макромолекул ВМС является причиной набухания.
Количественной мерой набухания является степень набухания а, которая может иметь объемное или массовое выражение:

где V0, V, m0, m - соответственно объемы и массы исходного и набухшего полимера.
Более точным является определение а по ее массовому выражению, так как в этом случае результаты измерений не зависят от явления контракции. Контракция заключается в том, что объем раствора (смеси) двух жидкостей оказывается меньше, чем сумма объемов взятых жидкостей.
В зависимости от структуры полимера и температуры набухание может быть ограниченным или неограниченным (рис. 14.3). При ограниченном набухании (1) а достигает предельного значения, после чего набухание не зависит от времени (желатин в холодной воде). Для неограниченного набухания характерна зависимость (2), проходящая через максимум, после чего а падает до нуля в результате постепенного растворения полимера.
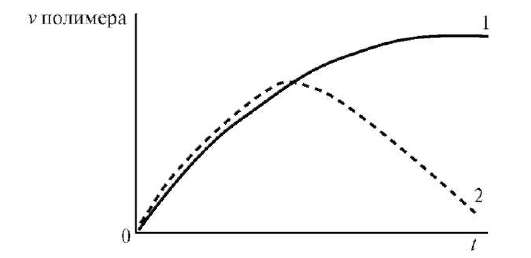
Рис. 3.Кривые ограниченного (1) и неограниченного (2) набухания
Ограниченность или неограниченность набухания определяются соотношением энергий связей в полимере с энергией сольватации и энтропийным фактором. В линейных и разветвленных полимерах молекулы связаны ван-дер-ваальсовыми силами, энергия этих связей невелика, поэтому энергия сольватации и энтропийный фактор уже при комнатной температуре превышают их. При таких условиях набухание идет неограниченно. Если между цепями полимера имеются химические связи, то для их разрыва недостаточно бывает энергии соль-
ватации и энтропийного фактора. Набухание протекает ограниченно, и полимер превращается в студень.
В основе процесса набухания лежит сольватация макромолекуляр-ных цепей. О сольватационном механизме набухания свидетельствуют выделение теплоты набухания и контракция (уменьшение общего объема системы). В то время как при набухании объем полимера всегда увеличивается, объем всей системы (полимер + растворитель) обычно уменьшается. Это особенно заметно при набухании полярных полимеров в полярных растворителях. Причиной контракции является упорядоченная ориентация молекул растворителя в сольватных слоях. Набухание, как и сольватация, специфично, так как полимер набухает в растворителе, соответствующем его природе. В процессе набухания происходит односторонняя диффузия молекул воды в полимер. Это объясняется тем, что крупные макромолекулы, связанные в надмолекулярные структуры, практически не могут переходить в растворитель, а мелкие и хорошо диффундирующие молекулы воды легко проникают в полимер, увеличивая его объем. При набухании отдельные молекулы надмолекулярных структур гидратируются, межмолекулярное взаимодействие значительно ослабевает, в результате чего становится возможной диффузия макромолекул в растворитель (рис. 14.4).

Рис. 4.Взаимодействие растворителя с полимером: 1 - межструктурное набухание; 2 - внутриструктурное набухание; 3 - растворение
Набухание является экзотермическим процессом, поэтому в соответствии с принципом Ле Шателье степень набухания увеличивается при увеличении давления и уменьшении температуры, однако скорость набухания при уменьшении температуры уменьшается, так как при более низких температурах диффузия протекает менее интенсивно.
Процесс набухания включает две стадии. На первой происходит выделение теплоты набухания наблюдается контракция системы, однако а не достигает высоких значений. Вторая стадия почти не сопровождается контракцией и выделением теплоты, но характеризуется увеличением а и объема набухающего полимера.
При набухании полимеров их объем увеличивается в 10-15 раз, и возникает давление набухания, достигающее иногда сотен мегапаска-лей. Силу давления при набухании крахмала и белков гороха раньше использовали для разъединения костей черепа при приготовлении анатомических препаратов. Давление набухания эквивалентно внешнему давлению, приложение которого могло бы остановить увеличение объема набухающего полимера.
Степень набухания полимера и его способность к растворению зависят от гибкости полимерных цепей. Так, волокна незрелого коллагена (в котором еще не установились поперечные ковалентные «сшивки») достаточно хорошо набухают и могут переходить в раствор, тогда как волокна зрелого коллагена нерастворимы. На интенсивность процесса набухания влияют также температура, давление, присутствие электролитов и величина pH.
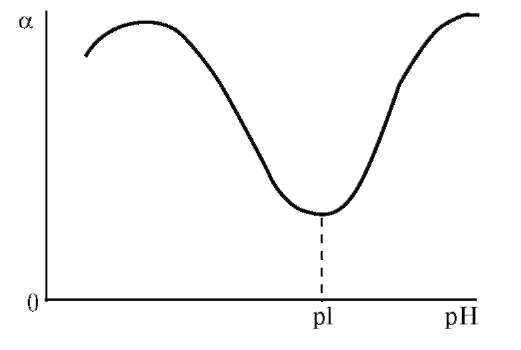
Рис. 5.График зависимости степени набухания белка от pH среды
Влияние pH среды на набухание особенно выражено для полиамфо-литов. Зависимость степени набухания белка от pH среды выражается кривой с двумя максимумами и одним минимумом, положение которого соответствует изоэлектрической точке (рис. 14.5). Примером влияния pH на набухание является отек кожи, вызываемый действием муравьиной кислоты, содержащейся в крапиве и выделениях муравьев.
Экспериментально установлено, что на набухание биополимеров анионы оказывают большее влияние, чем катионы. Анионы по степени влияния на набухание белков располагаются в лиотропный ряд (ряд Гоффмейстера):
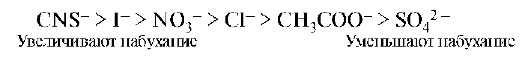
Дата добавления: 2016-11-26; просмотров: 3195;











