Изоэлектриеская точка полиамфолитов
Белки относятся к полиамфолитам, т.е. к веществам, способным в зависимости от условий проявлять свойства как оснований, так и кислот. Остатки ионогенных аминокислот (аспарагиновой и глутаминовой кислот, аргинина, лизина и гистидина) могут находиться как в прото-нированной, так и в депротонированной формах. Состояние, при котором суммарный заряд полиамфолита равен нулю, называется изоэлек-трическим. Значение pH раствора, соответствующее изоэлектрическому состоянию, называется изоэлектрической точкой(pi). В среде с большей кислотностью, чем в изоэлектрической точке (pH < pi), ионизация карбоксильных групп подавлена, вследствие чего белок находится в форме макрокатионов, положительный заряд которых обусловлен наличием -R-NH3+-групп. В среде с меньшей кислотностью, чем в изоэлек-трической точке (pH > pi), карбоксильные группы депротонированы, вследствие чего белок находится в форме макроанионов, отрицательный заряд которых обусловлен наличием -R-СОО--групп.
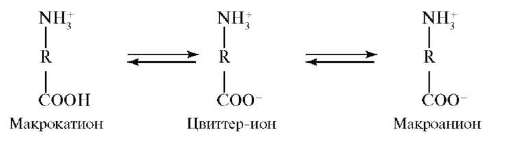
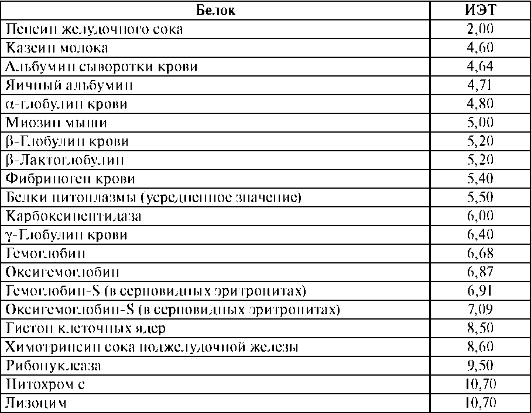
Возникновение электрического заряда в состоянии, отличающемся от изоэлектрического, обусловливает электрофоретическую подвижность белков. Направление движения макромолекул белков в электрическом поле (к катоду или аноду) зависит от значения pH. Белки, как и все амфолиты, имеют определенную величину изоэлектрической точки. В таблице 14.1 приведены значения изоэлектрических точек некоторых наиболее распространенных белков.
Таблица 14.1.Изоэлектрические точки некоторых белков
При pH <pi протонируются основные группы в боковых цепях; белок находится в форме макрокатиона и перемещается к катоду. При pH = pi белок находится в электронейтральной форме (макромолекула) и в электрическом поле не перемещается. При pH >pi белок перемещается к аноду, так как находится в форме макроаниона вследствие депротонирования кислотных групп в боковых цепях. Макроанионы различаются электрофоретической подвижностью, которая зависит от размера иона и его заряда. Изменяя pH поддерживающей среды, можно добиться значительного изменения подвижности макроаниона:
она будет тем больше, чем больше разница между pH и pi. Например, для белка с pi = 5 при pH 9 степень депротонированности боковых ионогенных групп больше, чем при pH 7. Больший заряд макроаниона при pH 9 обусловливает его большую подвижность (рис. 14.2).
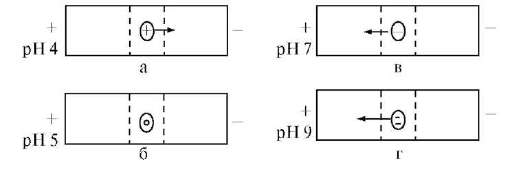
Рис. 2.Зависимость подвижности частиц белка (pi = 5) в электрическом
поле от pH среды
Описанные закономерности используются в электрофоретическом методе анализа белков. С помощью электрофореза можно разделить на отдельные фракции сложные смеси белков. Некоторые заболевания сопровождаются изменением состава и соотношения белков, что отражается на электрофореграммах.
Дата добавления: 2016-11-26; просмотров: 3920;











