Сильные электролиты
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ.
Образование раствора – это сложный процесс. В растворах происходит взаимодействие между растворенным веществом и растворителем.
Взаимодействие их приводит к образованию сольватов(гидратов-если растворитель вода).
В ряде растворов в результате взаимодействия растворенного вещества и растворителя происходит электролитическая диссоциация растворенного вещества – образование ионов. Поэтому растворы различают по способности проводить электрический ток: электролиты, неэлектролиты..
Электролиты– это соединения, молекулы которых в растворах или в расплавах находятся в виде ионов.( Т.е. это вещества,которые диссоциируют на катионы и анионы)
Диссоциация электролитов характеризуется степенью электролитической диссоцации (α).
α = Число диссоциированных молекул
Общее число растворенных молекул
Степень диссоциации αравна отношению числа диссоциированных молекул к общему числу растворенных молекул в единице объема раствора.
Степень диссоциации может быть выражена в долях и процентах (0≤ α ≥ 1) и (0%≤α ≥100%).
Например, выражение «степень диссоциации СН3СООН в 0,01 М растворе при данной температуре равна 0,014» означает , что 1,4% уксусной кислоты в этом растворе продиссоциировало, а 98,6% находится в виде недиссоциированных молекул.
Степень диссоциации определяют экспериментально.
Степень диссоциации зависит
· от природы вещества электролита,
· растворителя,
· температуры и
· концентрации раствора.
Различают: сильные, слабые электролиты.
Сильные электролиты
-кислоты, основания, большинство солей.

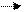
 У них α 1( 100%), но экспериментально α <1.
У них α 1( 100%), но экспериментально α <1.
Это объясняется теорией электролитов(Дэбай,Хюккель):вокруг ионов в растворе
образуется ионная атмосфера.(Рис. а,б,в)
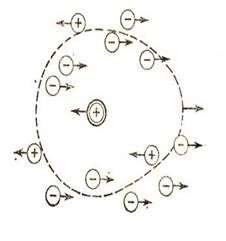
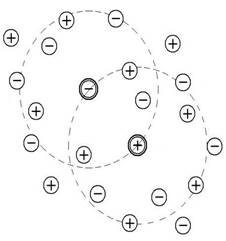
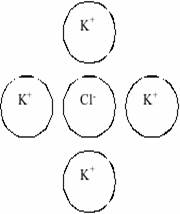
Рис.а Рис.б Рис.в
Влияние ее сказывается значительно только в концентрированных растворов.
При увеличении концентрации свойства раствора отклоняются от свойств идеального раствора, и кажется, будто реальная концентрация ионов становится меньше (т.к. меньше электропроводимость среды -ионная атмосфера как бы «тормозит» движение носителей зарядов).
Активность иона (a)- эффективная, кажущаяся концентрация, в соответствии с которой ионы вступают в химические взаимодействия.
Коэффициент активности (f). -мера отклонения активности иона от его концентрации.Он равен отношению активности иона к истинной концентрации иона: f= а/С, следовательно
а=fc
В идеальных растворах и близких к ним по свойствам разбавленных(C≤10-3 моль/л) растворах f→1 и а → С.
Отклонения от идеального состояния объясняется не только влиянием концентрации ионов, но и влиянием их заряда.
Оба эти фактора учитывает величина
Ионная сила раствора –μ ( или I)
Она равна численно равна полусумме произведения концентраций всех ионов (Сi, моль/л) в растворе на квадрат заряда каждого иона (Zi):
I = 1/2 * Σ(Сi*zi2]
Пример.
Дата добавления: 2016-11-04; просмотров: 1535;











