Вычислить ионную силу раствора, в 1 л которого содержится
14,2 г. Na2SO4 и 7,45 г. KCl.
Решение.
 Уравнения диссоциации Na2SO4 2Na++SO42-
Уравнения диссоциации Na2SO4 2Na++SO42-
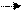 KCl K+Cl
KCl K+Cl
Определим молярные концентрации самих солей и ионов
М(Na2SO4)=142 г/моль, См(Na2SO4) = 14,2/142 = 0,1моль/л.
С(Na+)=2C(Na2SO4)=0,2 моль/л,
С(SO42-)=C(Na2SO4)=0,1 моль/л
М(KCl) = 74,5г/моль . См(KCl) = 7,45/74,5 = 0,1 моль/л.
I= 0,5(С(Na+)*ZNa+2+ С(SO42-)* Z SO42-2 + С(K+)*ZK+2+ С(Cl-)*ZCL-2 =
=0,5 ( 0,2* 12 + 0,1*22 + 0,1*12 + 0,1*12) = 0,4.▄
Зависимость коэффициента активности от ионной силы очень разбавленного раствора определяется по формуле Дебая-Хюккеля:
lg f = - 0,5z2 * (I)1/2.
Значения коэффициентов активности различных ионов для растворов с различной ионной силой можно также найти в справочных таблицах.
Слабые электролиты. Закон разбавления Оствальда
 Диссоциация слабых растворов – обратимый процесс, к которому применим закон действия масс: например, СH3COOH = CH3COO- +H+
Диссоциация слабых растворов – обратимый процесс, к которому применим закон действия масс: например, СH3COOH = CH3COO- +H+
В растворе устанавливается состояние равновесия: скорость прямого процесса равна скорости обратного.
Это состояние описывается
КОНСТАНТОЙ РАВНОВЕСИЯ (К),
например в общем виде для слабой кислоты
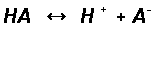 диссоциация
диссоциация
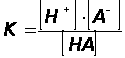 ,где [ ]- равновесные концентрации частиц
,где [ ]- равновесные концентрации частиц
Константу равновесия процесса диссоциации называют
константой диссоциации (К дисс)
Если диссоциация слабого электролита протекает по ступеням, то каждая ступень диссоциации характеризуется своей константой:
1-я ступень: 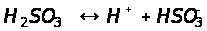
2-я ступень: 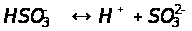

При этом всегда K1>>K2,
Kобщ = K1·K2
Кобщ=1,2·10-2 * 6,2· 10-8=7,44·10-10(пример сернистой кислоты)
Константа диссоциации не зависит от концентрации и является строгой характеристикой силы электролита при данной температуре.
Для электролитов средней силы и слабых электролитов (Kдисс < 10-4) величины констант диссоциации приведены в справочных таблицах.
Связь Кдисс и степени диссоциации.
Рассмотрим процесс диссоциации электролита НА с концентрацией с и степенью диссоциации 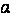 :
:
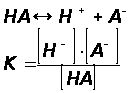
Согласно уравнению диссоциации:
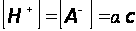 Тогда
Тогда 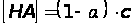
После подстановки полученных выражений в уравнение для константы диссоциации получим:
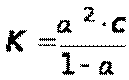
Так как α<<1, то её величиной в знаменателе можно пренебречь,тогда
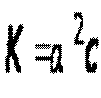
Или 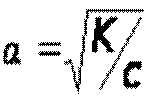
Полученное математическое выражение
Закон разбавления Оствальда:
степень диссоциации электролита возрастает при разбавлении раствора.
Например, при разбавлении раствора в 4 раза, степень диссоциации увеличится в 2 раза
Дата добавления: 2016-11-04; просмотров: 3612;











