Поскольку в молекулах аминокислот имеются амино- и карбоксильные группы, они вступают в реакции, характерные для этих функциональных групп.
Рассмотрим со свойствами аминокислот, которые обусловлены одновременным присутствием в структуре молекул обеих функциональных групп.
– Наличие в молекуле аминокислоты кислотной и основной групп обуславливает амфотерность этих соединений и существование их в виде биполярного иона. В кислой среде образуется катион соли аминокислоты как основания, в щелочной – анион соли аминокислоты, как кислоты.
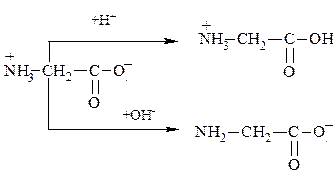
рН среды, при которой амфотерное соединение – аминокислота, наименее или в равной мере диссоциирует по обоим направлениям, называется изоэлектрической точкой.
Такое значение рН называют изоэлектрической точкой и обозначают рНиэт или рI. Для моноаминомонокарбоновых кислот изоэлектрическая точка рассчитывается как среднее арифметическое двух значений рКa. Например для аланина она равна:
рI = ½ × (рКa1 + рКa2) = ½ × (2,34 + 9,69) = 6,02
При значении рН, превышающем изоэлектрическую точку, аминокислота заряжается отрицательно, а при значении рН ниже рI аминокислота несет суммарный положительный заряд. Например, при рН = 1,0 все молекулы аланина существуют в форме ионов
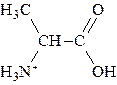
с суммарным зарядом +1. При рН = 2,34, когда имеется смесь равных количеств ионов
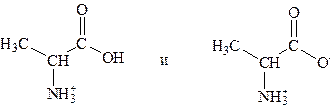
суммарный заряд = +0,5. Аналогичным образом можно предсказать знак и величину суммарного заряда для любой другой аминокислоты при любом значении рН.
В изоэлектрической точке аминокислота существует в виде биполярного иона (в целом электрически нейтрального соединения), поэтому в изоэлектрической точке водные растворы аминокислот неэлектропроводны. Кислотно-основные свойства аминокислот используются для разделения и последующей идентификации аминокислот методами электрофореза и ионообменной хроматографии. Оба эти метода основаны на различиях в знаке и величине суммарного электрического заряда при данном значении рН.
– С основаниями аминокислоты образуют соли. Особенно характерно образование медных солей, имеющих интенсивную синюю окраску. Эти вещества являются внутрикомплексными соединениями
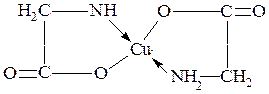
– Химическое поведение аминокислот в значительной мере определяется взаимным расположением аминогруппы и карбоксила. Особенно ярко это проявляется при нагревании аминокислот.
α-Аминокислоты при нагревании легко отщепляют воду и дают дикетопиперазины.
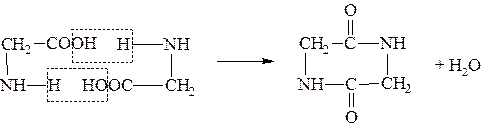
β-Аминокислоты отщепляют аммиак и образуют аммонийную соль непредельной кислоты
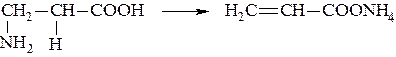
γ и δ-Аминокислоты отщепляют воду внутримолекулярно и дают лактамы
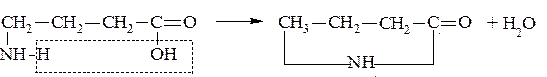
Для пищевиков представляет интерес реакция аминокислот с соединениями, содержащими карбонильную группу С=О, с различными альдегидами и восстанавливающими сахарами (глюкозой, рибозой и отчасти фруктозой). В результате этой реакции происходит разложение как исходной аминокислоты, так и реагирующего с ней восстанавливающего сахара.
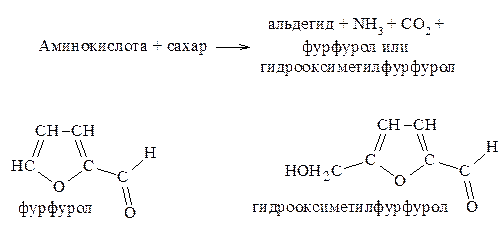
Дата добавления: 2016-06-15; просмотров: 2636;











