Растворы электролиты. Теория электролитической диссоциации
Если раствор обладает большей электропроводностью, чем чистый растворитель, то это - раствор электролита. Электролиты - это вещества, растворы которых, в отличие от растворов неэлектролитов, проводят электрический ток, так как в растворах электролитов имеются подвижные заряженные частицы (ионы). Процесс распада вещества на ионы при растворении называется электролитической диссоциацией. Основные положения теории электролитов описываются теорией электролитической диссоциации (С. Аррениус, 1887 г.) и теорией сильных электролитов:
1) при растворении вещество полностью или частично распадается на ионы, что и увеличивает электропроводность растворов по сравнению с растворителем;
2)ионы в растворе образуют ионосольваты (ионогидраты) с помощью сил различной природы - от донорно-акцепторных до вандерваальсовых; при этом концентрация свободного растворителя в растворе уменьшается;
3)сильно разбавленные растворы электролитов во многих случаях ведут себя как идеальные, их свойства определяются в основном числом частиц в растворе и не зависят от природы этих частиц;
4)в концентрированных растворах имеет место отклонение от свойств идеальных растворов из-за сильного взаимодействия противоположно заряженных ионов, которые образуют сложные частицы - нейтральные и заряженные, что уменьшает количество частиц по сравнению с тем, что получилось при диссоциации.
Проводимость разбавленных растворов и растворов слабых электролитов пропорциональна концентрации ионов. Поэтому, измеряя электропроводность растворов, судят об их свойствах, зависящих от концентрации ионов.
Количественной характеристикой процесса диссоциации является степень электролитической диссоциации (a):
a = 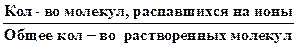 . (6.15)
. (6.15)
По величине a различают сильные (a ³ 0,3) и слабые электролиты. В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации - ионами. Например, для реакции диссоциации уксусной кислоты в водном растворе устанавливается равновесие:
 CH3COOH
CH3COOH  CH3COOH- + H+ ,
CH3COOH- + H+ ,
которое количественно характеризуется константой равновесия (в этом случае ее называют константой диссоциации - Кд):
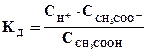 . (6.16)
. (6.16)
Так как 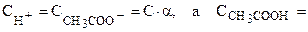 (1 - a)·С
(1 - a)·С
(С - концентрация), то
Кд = 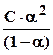 (а) и при a <<1
(а) и при a <<1 
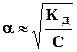 (б) . (6.17)
(б) . (6.17) 
Выражение (6.17) -закон разбавления Оствальдадля слабых электролитов, молекулы которых диссоциируют на 2 иона. При большем числе ионов выражение усложняется. Так, для электролита состава KnAm :
KnAm = nKm+ + mAn- , 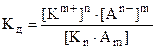 ;
;
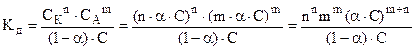 .
.
Для слабых электролитов (1-a) » 1 и 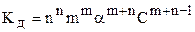 ;
;
a 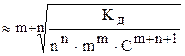 .(6.18)
.(6.18)
Экспериментально определяемые для сильных электролитов степени диссоциации называют кажущимися (aкаж). Как правило, aкаж не равна 100 % (или 1), что связано с объединением части ионов в нестойкие ионные пары или агрегаты ионов. Из закона разбавления следует, что a увеличивается с уменьшением концентрации (С).
Коллигативные свойства (DP, DТкип, DТзам, Pосм) для растворов электролитов сильно отличаются от рассчитываемых по формулам (6.6 – 6.10) (см. раздел 6.4), т.к. в этих растворах на самом деле больше частиц (ионов и молекул), чем растворено молекул. Это обстоятельство учитывается с помощью изотонического коэффициента (i), который показывает, во сколько раз концентрация частиц в растворе (Ссумм) больше, чем число растворенных молекул (C) : 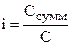 .
.
Для вышеприведенного уравнения можно записать:
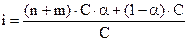 ,
,
обозначив общее число ионов (n + m) через k и сократив С, получим:
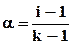 . (6.19)
. (6.19)
Здесь k – максимальное число ионов, на которые может распадаться формульная единица или молекула. Очевидно, что 1 < i < k.
Тогда коллигативные свойства для растворов электролитов будут определяться по формулам:
DР = i·Р10·χ2 ; DТкип = i×Кэ×Cm ;
DТзам = i×Kк×Cm ; Pосм = i×C×R×T×. (6.20)
Из этих формул, также как и в случае неэлектролитов, можно приближенно находить молярные массы растворенных веществ.
Пример 15. Вычислить осмотическое давление (при 17oС) раствора Na2SO4, в 1л которого содержится 7,1 г растворенной соли. Кажущаяся степень диссоциации (aкаж) соли в растворе составляет 0,69 (69 %).
Решение. Производим вычисление осмотического давления исходя из предположения, что никакой диссоциации в растворе нет. В этом случае согласно закону Вант-Гоффа (6/10):
Росм = C·R·T = 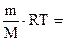
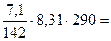 120,5 кПа.
120,5 кПа.
Полученное значение следует увеличить в i раз. Коэффициент i можно вычислить по приведенной выше формуле (6.19), т.е. a×(k - 1) = (i - 1), k = 3.
Отсюда i = 2a + 1 = 2·0,69 + 1 = 2,38. Росм.(Na2SO4) = 2,38×120,5 = 286,79 кПа.
Дата добавления: 2016-07-05; просмотров: 1784;











