Комплексные соединения как электролиты
В водных растворах, комплексные соединения полностью диссоциируют на ионы внешней и внутренней сферы, так как связь между ними ионная:
[Cu(NH3)4](OH)2 → [Cu(NH3)4]2+ + 2ОН–.
Нейтральные комплексные соединения не диссоциируют на ионы, т.е. являются неэлектролитами. Комплексный ион – слабый электролит диссоциирует на ион-комплексообразователь и лиганды.
[Cu(NH3)4]2+ D Cu2+ + 4NН3
Прочность комплексного иона, характеризующаяся константой диссоциации, называется константой нестойкости:
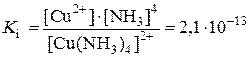 .
.
Чем меньше константа нестойкости, тем прочнее комплексный ион. Поскольку процесс диссоциации комплексного иона обратим, то равновесие можно сместить вправо и вызвать разрушение комплекса, если в раствор ввести вещество, связывающее комплексообразователь или лиганды в более прочное соединение в соответствии с правилом Бертолле.
Например, комплексное соединение K2[HgBr4] будет разрушаться при добавлении в раствор иодида калия и образованием нового соединения K2[HgI4], комплексный ион, которого является более слабым электролитом:
K2[HgBr4] + 4KI = K2[HgI4] + 4KBr,
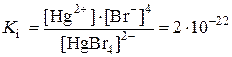 ,
,
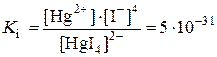 .
.
Комплексный ион может разрушаться в случае образования труднорастворимого соединения. Так, комплексный ион [Ag(NH3)2]+ разрушается при добавлении в раствор сульфида калия и образованием сульфида серебра, который имеет ПР = 5,9 · 10–52, тогда как константа нестойкости комплексного иона Kн = 6,8 · 10–8:
[Ag(NH3)2]+ +S2– → Ag2S↓ + 2NH3
Комплексные соединения могут вступать в окислительно-восстановительные реакции замещения иона-комплексообразователя:
Zn + 2K[Au(CN)2] = 2Au + K2[Zn(CN)4],
Металлический цинк замещает золото в составе комплекса, образуя при этом более прочный тетрацианоцинкат-ион.
В некоторых ОВР происходит разрушение комплекса с образованием более простых по составу продуктов реакции:
2K2[Ni(CN)4] + Br2 + 6KОН = 2Ni(OH)3↓ + 8KCN + 2KВr.
В этой реакции ион никеля окисляется бромом до степени окисления +3. В щелочной среде ион никеля образует малорастворимый гидроксид, выпадающий в осадок. Т.о. свойства комплексных соединений в растворах подчиняются правилу Бертолле.
Контрольные вопросы
1.Изложите основные положения теории Вернера.
2. Чем объясняется способность d-металлов образовывать комплексные соединения?
3. Объясните механизм образования связей между ионом-комплексообразователем и лигандами, между внешней и внутренней сферами.
4. Изложите правила номенклатуры комплексных соединений.
5. Опишите диссоциацию комплексного соединения. Дайте определение константы нестойкости комплексного иона.
6. Охарактеризуйте химические свойства комплексных соединений.
Дата добавления: 2017-11-21; просмотров: 3869;











