Термодинамический анализ возможности протекания химического процесса
Изменение энергии Гиббса и Гельмгольца служит критерием направления самопроизвольного процесса в закрытых системах.
При осуществлении самопроизвольного процесса система в состоянии произвести работу 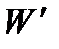 . При этом
. При этом 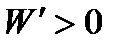 и, следовательно,
и, следовательно, 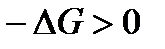 . Отсюда вытекает очень важное соотношение, которое является критерием возможности самопроизвольного протекания потекания процесса в закрытой системе в изобарно-изотермических условиях:
. Отсюда вытекает очень важное соотношение, которое является критерием возможности самопроизвольного протекания потекания процесса в закрытой системе в изобарно-изотермических условиях:
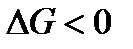 (при p = const и T = const)
(при p = const и T = const)
Аналогично можно показать, что в изохорно-изотермических условиях критерием возможности самопроизвольного процесса является:
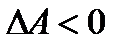 (при V = const и T = const)
(при V = const и T = const)
Таким образом, в закрытых системах, какими являются большинство химико-технологических систем, ответ на этот вопрос получают на основании изменения энергии Гиббса или энергии Гельмгольца:
В закрытых системах самопроизвольные процессы могут протекать только в направлении уменьшения энергии Гиббса (при p = const и T = const) или энергии Гельмгольца (при V = const и T = const), а в состоянии равновесия эти функции имеют минимальное значение.
Дата добавления: 2021-01-26; просмотров: 651;











