Боровская теория атома водорода
Теория атома, предложенная Н. Бором, основана на двух постулатах.
1. Электрон в атоме может находиться только в одном из дискретных стационарных состояний, удовлетворяющих правилу квантования 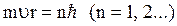 . При этом излучение и поглощение энергии не происходит.
. При этом излучение и поглощение энергии не происходит.
2. Излучение испускается или поглощается в виде светового кванта энергии 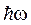 при переходе электрона из одного стационарного состояния в другое. Энергия светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона:
при переходе электрона из одного стационарного состояния в другое. Энергия светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона:
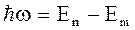 . (17)
. (17)
Применение этих постулатов для расчета параметров атома водорода позволило найти:
1) радиусы стационарных орбит
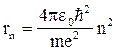 ; (18)
; (18)
2) cкорости движения электрона на этих орбитах
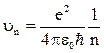 ; (19)
; (19)
3) энергии стационарных состояний атомов
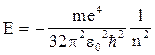 ; (20)
; (20)
4) длины волн спектральных линий, возникающих при переходах электрона из одного стационарного состояния (с номером n1) в другое (с номером n2):
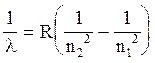 , (21)
, (21)
где 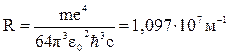 – постоянная Ридберга.
– постоянная Ридберга.
При этом возникает несколько спектральных серий (групп линий) в зависимости от номера энергетического уровня n2, на который переходит электрон:
n2 = 1 – серия Лаймана,
n2 = 2 – серия Бальмера,
n2 = 3 – серия Пашена,
n2 = 4 – серия Брэккета.
Ядерная физика
Дата добавления: 2016-10-26; просмотров: 2584;











