Инфекционно-паразитарная теория неоплазии и теория вирусного канцерогенеза
Инфекционно-паразитарная теория неопластического роста — часть замечательного наследия, оставленного современной медицине эпохой монокаузализма. Впервые идею об инфекционной (точнее — инвазионной) этиологии опухолей выдвинули, вероятно, исследователи бильгарциоза — Бильгарц (1851) и Эберт (1868). Бильгарциоз (разновидность шистосоматоза) — древнейшее паразитарное заболевание, вызываемое печёночной двуусткой Shistomum haematodium Bilharzii, промежуточный хозяин которой — пресноводная улитка. Бильгарциоз характерен для тропиков и субтропиков Африки и Центральной Америки.
Особенно велика пораженность в дельте Нила у египетских феллахов, работающих на затопляемых почвах. Этот район — природный очаг бильгарциоза. Яйца шистосом обнаружены еще у древнеегипетских мумий, и до сих пор данный гельминтоз поражает в мире десятки миллионов людей. Наиболее важной для онкологии особенностью бильгарциоза служит тот факт, что на месте локализации яиц двуустки (легкие, печень, толстая кишка, мочевой пузырь) с высокой частотой отмечается рак и саркомы.
Эберт полагал, что токсины двуустки могут вызывать неопластическую трансформацию клеток. В настоящее время имеются предположения о том, что при бильгарциозе в организм попадают опухолеродные вирусы или естественные канцерогены, в результате реакции на паразит вырабатываются ко- канцерогенные факторы роста, а иммуносупрессорный эффект, оказываемый гельминтами, способствует развитию неоплазм. Паразитарная теория канцерогенеза имела и дальнейшее достаточно плодотворное развитие.
В начале XX века установили связь между другим гельминтозом — цистицеркозом и саркомой печени крыс (Боррель, 1906). Паразитарная модель этого неопластического заболевания была получена Баллоком и соавторами (1910), путём чрез желудочного заражения крыс цистицерками Taenia crassicolis, паразитирующими у кошек, через 8-17 месяцев после инвазии.
Самбон предположил, что гельминты переносят фильтрующийся онкогенный «токсин». В настоящее время известно, что иммунопатологические реакции в ответ на введение цистицерк провоцировали у животных активизацию эндогенного онкогенного агента (Шабад, 1981).
Классическими являются эксперименты датского патолога Фибигера (1907, 1913), уже описывавшиеся при обсуждении достижений и проблем монокаузализма. Исходным пунктом послужили эпидемиологические данные о повышенной частоте рака желудка у рабочих копенгагенского сахарного завода. Далее на предприятии были обнаружены в изобилии тараканы и крысы. У них циркулировал паразит Spiroptera neoplastica. Таракан-пруссак Periplaneta americana — его промежуточный, а млекопитающие -- окончательный хозяин.
У крыс личинки этой нематоды попадают в эпителий мостов видного кармана желудка и, реже — обнаруживаются в пищеводе и языке. При вскрытии животных и умершего от рака желудка пациента Фибигер обнаружил в опухоли паразитов. Тогда он заразил спироптерой 102 крысы, у 60% из которых в течение 1,5-4 месяцев после инвазии сформировались сначала папилломы, а затем — плоскоклеточный рак желудка или рак языка.
Близкие по своей биологии к спироптерам гельминты Trichosoma новообразований не вызывали. Автор заключил, что какие-то биологически активные продукты, выделяемые именно спироптерой, способствуют развитию новообразований.
В 1926 г. Нобелевский комитет счёл это вполне доказанным и присудил Фибигеру Нобелевскую премию по медицине, с официальной формулировкой «за раскрытие этиологии рака желудка». Правда, в 1928 г. Фудзимакой, а затем — Пасси и Лизом было показано, что большое значение в развитии наблюдавшихся случаев спироптерозного рака имела не столько сама спироптера, сколько особенности диеты и реактивности крыс, у которых этот паразит вызывал повышение потребности в ряде витаминов, включая и имеющие отношение к синтезу нуклеиновых кислот.
Таким образом, монокаузальный подход мог успешно поставлять факты для понимания механизмов канцерогенеза, но не был достаточным для формирования стройной теории этого полиэтиологического патологического процесса. В 30-50-е годы XX столетия взаимоотношения химической и инфекционной теорий неопластического роста характеризовались конкуренцией и противоречиями, разворачивались непримиримые дискуссии категорически оппонировавших друг другу специалистов — см. например, сведения по истории этого периода развития теоретичесой онкологии в интереснейшей книге Парнес (1974).
Роль паразитарных инвазий в онкогенезе подчас очень важна — это роль существенных условий данного процесса, без которых его вероятность сильно снижается. И поныне признаётся, например, важнейшее значение хронической малярии в возникновении лимфомы Бёркитпта. Географические очертания малярийного пояса и ареала распространения лимфомы Бёркитта совпадают. В-клеточный фактор роста, выделяемый при малярии, способствует выживанию трансформированных другим онкогенным агентом (вирусом Эпштейна-Барр) лимфоидных клеток на определённой стадии многошагового онкогенеза.
В конце XIX столетия обнаружение микроорганизмов в опухолеподобных образованиях растений (Вилемен де Нанси, 1881) вдохновило ряд микробиологов, попытавшихся найти бактериального или грибкового возбудителя рака. Историю таких исследований излагает Подвысоцкий (1905). Однако, попытки воспроизвести истинные неоплазмы с помощью постулировавшихся канцерогенных микробов, высеянных из опухолей: Bacillus neoformans Смит- са, Bacillus tumifaciens Блюменталя и соавторов, бактерии Гловера и кокка Нузума — не были успешными и воспроизводимыми, что свидетельствовало об отсутствии причинной роли этих микроорганизмов в генезе новообразований.
В 1892 г. наш соотечественник, крымский ботаник Ивановский описал свойства принципиально нового патогена — фильтрующегося вируса табачной мозаики. Но еще до этого, не используя самого термина «вирус», Саймон (1876) предположил, что для возникновения неоплазии необходима «копуляция нормальных клеток с контагиозным ферментом», превращающимся в клетках в активно действующую форму. Стоит отметить, что всё это высказывалось на фоне полемики о природе ферментов, а затем — и природе вирусов («существа это или вещества?»).
Приоритет формулировки предположения о вирусном онкогенезе приписывается французским авторам Боррелю и Боску (1903).
Поначалу гипотеза не нашла подтверждений ни при попытках перевивки опухолей человека и млекопитающих бесклеточными фильтратами, нив эпидемиологических исследованиях Бэшфорда (1908), опровергшего версию о заразности человеческого рака. Правда, дерматологу Чыоффо (1907) удалось доказать, что человеческие бородавки перевиваются при втирании бесклеточного фильтрата.
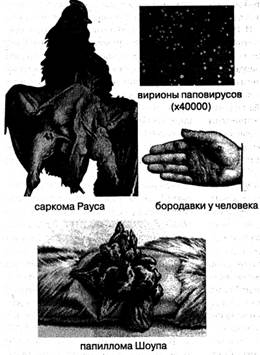
На этом фоне незамеченным прошло эпохальное открытие датских авторов Эллермана и Банга, перевивших куриный лейкоз бесклеточным фильтратом, тем более, что и лейкоз, и бородавки в начале XX столетия многими врачами ещё не считались болезнями истинно неопластической природы. Всего через 2 года американский учёный Раус (1910) доказал, что саркома кур передаётся не только с клетками птиц-доноров, но и с бесклеточным фильтратом и даже лиофилизированным порошком, полученными из ткани опухолей больных птиц.
Агент, передающий опухоль инактивировался 15-минутным прогреванием фильтратапри 56°С. Замечательной стороной работы Рауса было обнаружение «неперевиваемых сарком ограниченной злокачественности», которые вновь становились перевиваемыми, если привить их наиболее высокочувствительным курам. В этом уже содержалась исходная информация, позволяющая сделать предположение о том, что взаимоотношения вируса и клетки-мишени при онкогенезе отличаются от таковых при обычной заразной цитолитической вирусной инфекции.
Но ни эта тонкость, ни даже само открытие Рауса не получили никакого резонанса у современников, отвращённых от инфекционной теории рака неудачами бактериологов и воодушевлённых параллельными успехами в по? исках химических и лучевых канцерогенов (см, выше). Раус перестал заниматься данной проблемой, а Нобелевской премии за открытие своей юности удостоился ЛИШЬ в преклонные годы — 56 лет спустя, когда его данные были подтверждены, а роль ретровируса С в этиологии саркомы кур стала общепризнана (рис. 37).
В 30-е годы истекшего столетия усовершенствование иммунологических методов в вирусологии повлекло прогресс в деле экспериментальной проверки гипотезы вирусного канцерогенеза. В 1931 г. Гамалея предсказал грядущую интеграцию химической и вирусной гипотезы канцерогенеза и предсуществование латентных эндогенных опухолеродных вирусов, активируемых «стерильными канцерогенными веществами».
В 1932 г. Шоуп выделил вирус из доброкачественных фибром и папиллом кроликов и перевил их бесклеточным фильтратом здоровым животным, причём в крови кроликов были найдены антитела к вирусу, даже если сам он себя в экстрактах и фильтратах папиллом ничем не обнаруживал. Следовательно, опухолеродный вирус, действительно, мог существовать в клетках в латентном виде.
В одном случае Шоуп наблюдал возникновение у кролика карциномы на месте перевитой папилломы, но вирус оттуда вызывал при перевивке только папилломы. В 1934 г. Лнэке обнаружил в ядрах клеток леопардовых лягушек, поражённых спонтанным раком почки, вирусоподобные включения и перевил карциному с помощью лиофилизированного экстракта этих клеток.
Через 20 лет Майзл и соавторы доказали, что этиологическим агентом был вирус из группы герпес-вирусов. Наконец, историческое значение имело обнаружение у млекопитающих так называемого фактора молока, передающего рак молочной железы у мышей (Биттнер, 1934-1936). К тому моменту существовали полученные Слэем и соавторами генетически чистые линии высокораковых и низкораковых мышей, с соответствующими особенностями спонтанного развития рака грудной железы.
Опыты Биттнера продемонстрировали роль фактора со свойствами вируса, передаваемого через молоко, а также значение реактивности и условий в развитии рака молочной железы мышей. Мышата высокораковых линий не давали высокой частоты спонтанного рака данной локализации, если вскармливались матерями низкораковых линий.
Напротив, частота рака повышалась у потомства низкораковой линии, вскармливавшегося высокораковой матерью. При этом не было связи с тем, из какой линии происходил отец мышат. Уровень эстрогенов оказывал пермиссивный эффект — при достаточно большой эстрогенизации рак молочной железы мог быть получен даже у самцов мышей, вскармливавшихся молоком матери из высокораковой линии, а у самок высокораковой линии рак наступал тем раньше, чем чаще они рожали. В молоке и клетках опухолей были обнаружены вирусоподобные частицы. Вирус размножался в эксплантатах и не передавался через плаценту.
Опухоли развивались с большим латентным периодом, равным, примерно- половине средней продолжительности жизни мышей, что коррелирует с длительным латентным периодом новообразований у человека. До опытов Биттнера удавалось воспроизвести на животных с помощью вирусов лишь неоплазмы с относительно коротким латентным периодом. В настоящее время установлено, что рак молочной железы у мышей вызывается ретровирусом типа В (MMTV), а модель Биттнера имеет много черт, адекватных особенностям рака молочной железы человека (при этой форме человеческого рака описаны «раковые семьи», например, в XIX столетии доктор Кирквуд сообщил о семье, где от рака грудной железы умерли пять сестёр и их отец).
При данной форме рака имеется важная пермиссивная роль эстрогенов и прогестинов, выявляются в молоке и в неоплазмах частицы, сходные с биттнеровскими — см. ниже.
Дата добавления: 2023-04-21; просмотров: 585;











