Характеристики адсорбентов и их виды
В качестве адсорбентов применяются пористые твердые вещества с большой удельной поверхностью, обычно относимой к единице массы вещества. Адсорбенты имеют различные по диаметру капиллярные каналы— поры, которые условно могут быть разделены на макропоры (более 2×10-4 мм), переходные поры (6×10-6-2×10-4 мм), микропоры (2×10-6-6×10-6 мм). Характер процесса адсорбции определяется размером пор.
Удельная поверхность макропор относительно очень мала, поэтому на их стенках адсорбируется ничтожное .количество вещества. Макропоры играют роль лишь транспортных каналов для адсорбируемых молекул.
На поверхности переходных пор, размеры которых обычно значительно превышают размеры адсорбируемых молекул, в процессе адсорбции образуются слои поглощенного вещества. Возможно образование слоев толщиной в одну молекулу (мономолекулярная адсорбция) и в несколько молекул (полимолекулярная адсорбция).
Размеры микропор приближаются к размерам адсорбируемых молекул и адсорбция в микропорах приводит к заполнению их объема. Вследствие этого предположение об образовании слоев поглощенного вещества на поверхности микропор не имеет физического смысла. Обычно микропоры пересекаются макро- и переходными порами, что сокращает путь, проходимый адсорбируемыми молекулами, и приводит к ускорению адсорбции.
В больших порах диаметром более 2·10-4 мм и малых порах, сравнимых с диаметром молекул поглощаемого вещества, явление капиллярной конденсации отсутствует.
Адсорбенты характеризуются своей поглотительной, или адсорбционной, способностью, определяемой концентрацией адсорбтива в единице массы или объема адсорбента.
Поглотительная способность адсорбента по отношению к данному веществу зависит от температуры и давления, при которых производится адсорбция, и от концентрации поглощаемого вещества. Максимально возможная при данных условиях поглотительная способность адсорбента условно называется его равновесной активностью.
В промышленности в качестве поглотителей применяют главным образом активные угли и минеральные адсорбенты (силикагель, цеолиты и др.) а также синтетические ионообменные смолы (иониты).
Активные угли. Высокопористые активные угли получают путем сухой перегонки различных углеродсодержащих веществ (дерева, костей и др.) и активирования полученных углей для повышения их пористости. Активирование осуществляют прокаливанием угля при температурах ≤ 900 °С, а также другими способами, например удалением из пор угля смол и некоторых других продуктов сухой перегонки путем их экстрагирования органическими растворителями, окислением кислородом воздуха и др. Для повышения активности углей в них часто перед обугливанием вводят активирующие добавки (растворы хлористого цинка, кислот, щелочей и др.).
Удельная поверхность активных углей колеблется от 600 до 1700 м2/г. Размер гранул некоторых стандартных марок активных углей для адсорбции газов и паров составляет 1-5 мм (уголь БАУ) и 1.5-2.7 мм (уголь СКТ). Насыпная плотность углей этих марок равна 260 и 420 г/л соответственно. Применение углей того или иного вида зависит от разновидности процесса адсорбции, в котором они используются (поглощение газов, рекуперация летучих растворителей и т.д.).
Активные угли лучше поглощают пары органических веществ, чем воды, однако с повышением содержания влаги в активных углях их способность поглощать пары органических веществ снижается. Они применяются обычно для рекуперации летучих растворителей. Недостатком активных углей является их горючесть.
Силикагели. Эти адсорбенты представляют собой продукты обезвоживания геля кремневой кислоты, получаемые путем обработки раствора силиката натрия (растворимого стекла) минеральными кислотами или кислыми растворами их солей. Удельная поверхность силикагелей изменяется от 400 до 770 м2/г. Размер гранул колеблется от 0,2 до 7 мм, насыпная плотность составляет 400-800 г/л.
Силикагели применяются главным образом для осушки газов. Поглотительная способность силикагелей по отношению к парам органических веществ сильно снижается в присутствии влаги. Достоинством силикагелей является их негорючесть и большая механическая прочность, чем у активных углей.
Цеолиты. Эти адсорбенты представляют собой природные или синтетические минералы, которые являются водными алюмосиликатами катионов элементов первой и второй групп периодической системы Д.И. Менделеева. В качестве промышленных адсорбентов применяются главным образом искусственные (синтетические) цеолиты. Относительно недавно были получены цеолиты, обладающие весьма однородной структурой пор, размеры которых соизмеримы с размерами адсорбируемых молекул. Эти цеолиты проявляют молекулярно-ситовое действие, которое заключается в их способности не поглощать молекулы, диаметр которых больше диаметра пор. Молекулярно-ситовыми свойствами обладают также некоторые природные цеолиты, например натролит. Молекулярно-ситовое действие цеолитов часто используют в промышленной практике для разделения некоторых веществ, например нормальных и изопарафиновых углеводородов.
Цеолиты отличаются высокой поглотительной способностью по отношению к воде и являются высокоэффективными адсорбентами для осушки и очистки газов и жидкостей, в частности для глубокой осушки газов, содержащих небольшие количества влаги. Размер гранул цеолитов составляет от 2 до 5 мм.
Иониты. Эти адсорбенты представляют собой как природные, так и синтетические неорганические и органические вещества. К природным ионитам относятся цеолиты, глинистые минералы, ископаемые угли и др. Синтетическими ионитами являются плавленые цеолиты и молекулярные сита (цеолиты с правильной кристаллической структурой), ионообменные смолы, активированные минералы и органические вещества и др.
Иониты практически нерастворимы в воде, а также в обычных растворителях и обладают подвижными ионами, способными обмениваться на эквивалентное количество ионов (с зарядом того же знака) из раствора электролита, с которым поглотитель контактирует.
Иониты, содержащие кислые активные группы и обменивающиеся с раствором электролита подвижными анионами, называются анионитами, а иониты, содержащие основные активные группы и обменивающиеся подвижными катионами, — катионитами. Существуют также амфотерные иониты, способные к катионному и анионному обмену одновременно.
Типичные реакции ионного обмена:
1. Реакция анионного обмена
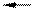
 2RC1 + Na2SO4 R2SО4 + 2NaCl
2RC1 + Na2SO4 R2SО4 + 2NaCl
где R — молекула ионита, связанная с подвижным ионом.
2. Реакция катионного обмена

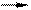 2NaR + СаСl2 CaR2 + 2NaCl
2NaR + СаСl2 CaR2 + 2NaCl
причем в обоих уравнениях выделены формулы веществ, составляющих твердую фазу.
Механизм ионного обмена обусловлен структурой и свойствами ионита. Так, например, иониты с кристаллической решеткой содержат в ее углах ионы, удерживаемые электростатическими силами; под действием этих сил и происходит в основном ионный обмен. Свойства многих ионитов связаны с их способностью к набуханию в водных растворах; набухание обычно сопровождается весьма значительным повышением давления.
Ионообменные смолы обладают большой обменной емкостью, избирательностью к отдельным ионам, химической стойкостью и механической прочностью. Поэтому сейчас они являются наиболее распространенными ионитами, практически вытеснившими в промышленных условиях иониты других типов.
Изменением состава активных групп при синтезе ионообменных смол можно получить иониты с весьма разнообразными свойствами.
Десорбция
Извлечение адсорбированного вещества из твердого поглотителя (десорбция) является необходимой составной частью всех технологических процессов адсорбции, проводимых в замкнутом цикле. Стоимость десорбции оказывает большое влияние на общую экономичность проведения процессов разделения и очистки веществ адсорбционными методами.
К числу основных методов десорбции (регенерации адсорбента) относятся:
- вытеснение из адсорбента поглощенных компонентов посредством агентов, обладающих более высокой адсорбционной способностью, чем поглощенные компоненты;
- испарение поглощенных компонентов, обладающих относительно высокой летучестью, путем нагрева слоя адсорбента.
В некоторых случаях для удаления из адсорбента смолообразных и других продуктов, образующихся в результате побочных процессов, окончательную очистку адсорбента осуществляют выжиганием этих компонентов (окислительная регенерация адсорбента).
Выбор того или иного способа десорбции производится на основе технико-экономических соображений, причем часто указанные выше способы применяются в комбинации друг с другом.
На практике процессы десорбции обычно осуществляют путем пропускания пара или газа, не содержащего адсорбтива, через слой адсорбента после завершения прямого процесса (адсорбции). Для повышения скорости извлечения десорбцию проводят наиболее часто при повышенных температурах, например, пропуская через слой адсорбента предварительно нагретый десорбирующий агент.
В качестве десорбирующих агентов используют острый насыщенный или перегретый водяной пар, пары органических веществ, а также инертные газы. После проведения процесса десорбции слой адсорбента обычно подвергают сушке и охлаждению.
Десорбцию острым водяным паром наиболее часто применяют в процессах рекуперации летучих растворителей та активном угле. При этом основная масса поглощенного вещества выделяется из поглотителя в начале десорбции. По мере приближения к концу процесса скорость его значительно снижается, а расход водяного пара на единицу десорбируемого продукта сильно возрастает. Поэтому из технико-экономических соображений адсорбируемое вещество извлекают из поглотителя не полностью, оставляя некоторое количество его в адсорбенте.
Часть водяного пара, называемая греющим паром, расходуется при десорбции на нагревание всей системы, десорбцию поглощенных веществ из угля и компенсацию тепловых потерь в окружающую среду. Греющий пар полностью конденсируется в адсорбере. Некоторая часть пара расходуется на компенсацию отрицательной теплоты смачивания угля водой и также полностью конденсируется в адсорбере.
Десорбированные из угля вещества выдуваются из угольного слоя динамическим паром, который, не конденсируясь, выходит из адсорбера в смеси с парами десорбированных веществ.
Расходы греющего пара и пара, идущего на компенсацию теплоты смачивания, находятся расчетом. Расход динамического пара зависит от условий проведения процесса и с достаточной надежностью определяется лишь опытным путем. При ориентировочных расчетах расход динамического пара можно принимать в среднем 3-4 кг на 1 кг десорбируемого вещества.
Регенерацию цеолитов наиболее часто проводят путем продувания сквозь слой адсорбента нагретого сухого газа, причем удаление поглощенных веществ из цеолитов обычно более затруднительно, чем из активных углей.
Процессы десорбции, подобно процессам собственно адсорбции, осуществляют не только в неподвижном, но также в движущемся и кипящем слоях адсорбента.
Дата добавления: 2016-10-18; просмотров: 12821;











