RedOX процессы. Редоксиметрия
Широко используются в качественном анализе, например,
Mn2+ открывают с помощью характерной реакции окисления до розово-фиолетового MnО4−.
Cr3+ обнаруживают по желтой окраске CrО42−, оранжевой Сr2O72− или синей окраске надхромовой к-ты Н2СrО6 в неводном растворителе.
Избирательное окисление применяют для разделения ионов, например, из смеси Cr(OH)3 + Fe(OH)3 хром переводят в раствор окислением в щелочной среде до CrО42−.
Окислительно-восстановительные процессы в количественном анализе – это титриметрические методы редоксиметрии (хроматометрия, перманганатометрия, иодометрия и т.д.), а также редокс индикаторы, у которых окраска меняется при достижении определенного значения окислительно-восстановительного потенциала системы. Например, бесцветный дифениламин NH(C6H5)2 в присутствии окислителей окрашивается в сине-фиолетовый цвет. Переход цвета происходит в некотором интервале значений потенциала от Eо индикатора.
Перманганатометрия
Основная реакция: MnO4−+5ē+8H+ ↔ Mn2++4H2O. Стандартный окислительно-восстановительный потенциал системы 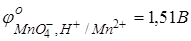 .
.
Первичный стандартный раствор:
1. Н2С2О4·2Н2О – щавелевая кислота, 0,02н раствор.
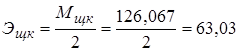 г/экв.
г/экв.
Реакция: С2О42− − 2ē ↔ 2СО2 .
2. Na2С2О4 − оксалат Na, щавелевокислый Na, 0,02н раствор.
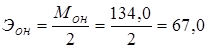 г/экв.
г/экв.
| Вторичный стандартный раствор (титрант) | Перманганат калия КМnО4, 0,02н р-р. 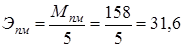 г/экв. г/экв.
|
| Фиксирование точки эквивалентности, ТЭ | 1. Безиндикаторный – по появлению устойчивой слаборозовой окраски.
2. Редоксиндикатор дифениламин изменяет цвет при  из бесцветного окисляется в сине-фиолетовый. из бесцветного окисляется в сине-фиолетовый.
|
| Определяемые вещества | 1. Окислители – методом обратного титрования. 2. Восстановители – методом прямого титрования. 3. Вещества типа солей кальция – методом замещения или избытка. |
Иодометрия
Основная реакция: I2 + 2ē ↔ 2I−. Йод – окислитель, йодид − восстановитель.
Индикатор (специфический) − 5% раствор крахмала.
Первичный стандартный раствор: Дихромат калия К2Cr2O7, 0,02н раствор.
Реакция: Cr2O72− + 6ē + 14 H+ ↔ 2Cr3+ + 7H2O.
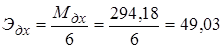 г/экв.
г/экв.
Вторичный стандартный раствор (титрант):
1. Тиосульфат натрия Na2S2O3·5H2O, 0,02н раствор.
Реакция: S4O62− + 2ē ↔ 2S2O32−, 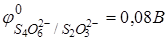 .
.
Этс = Мтс = 248,19 г/экв.
2. Йод I2, 0,02н раствор.
Рекция: I2 + 2ē ↔ 2I−, 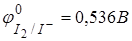 .
.
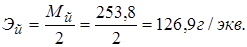
Вспомогательный раствор: 10% KI; 2н Н2SO4.
Индикатор: 0,5% раствор крахмала.
Определяемые вещества:
1. Окислители. Определяют методом замещения, например, дихромат калия; nдх = n 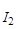 = nтc.
= nтc.
К2Cr2O7 + 6KI + 7Н2SO4 → Сr2(SO4)3 + 3I2 + 4К2SO4 +7H2O
3I2 + 2Na2S2O3 → 2NaI + Na2S4O6.
2. Восстановители. Определяют обратным титрованием, например, сульфит натрия; nсн = n 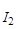 – nтс.
– nтс.
Na2SО3 + I2 + H2O → 2HI + Na2SO4 (+ избыток I2)
I2 (избыток) + 2 Na2S2O3 → 2NaI + Na2S4O6.
Комплексонометрия
Основная реакция: Na2H2EDТА + Ме2+ → Na2МеEDТА + 2Н+.
Первичные стандартные растворы:
Сульфат магния MgSO4, оксид магния MgO, оксид цинка ZnO, 0,01н растворы.
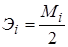 .
.
Вторичный стандартный раствор: Двунатривая соль этилендиаминтетрауксусной кислоты (трилон Б, комплексон-III) Na2H2EDТА•2Н2О (или Na2H2ЭДТА•2Н2О), 0,05н раствор.
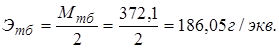
Структурная формула трилона Б:
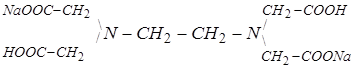 ,
,
Фиксирование ТЭ осуществляют индикаторным методом с применением металлоиндикаторов H2R. Это слабые органические кислоты, образующие неустойчивые окрашенные комплексы с катионами металлов, которые разрушаются в присутствии более сильных лигандов, входящих в комплексон. Титрование проводят в буферном слабощелочном растворе.
Mg2+ + H2R(синий) ↔ MgR(розовый) + 2H+
MgR(розовый) + Na2H2EDТА ↔ Na2MgEDTA + Н2R(синий)
Определяемые вещества:
1. Катионы, например, Са2+, Mg2+, Al3+, Fe3+, Tl4+ − прямым титрованием; 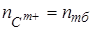 .
.
1. Анионы − обратным титрованием; 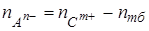 .
.
Вопросы
1. Сущность гравиметрического анализа.
2. Как достигается полнота осаждения осаждаемой формы?
3. Требования к гравиметрической форме в весовом анализе.
4. Методы объемного анализа по типам используемых реакций.
5. Требования к веществам для титрованных растворов.
6. Какие кислотно-основные индикаторы вы знаете?
7. От чего зависит внешний вид кривой титрования?
8. Что отражено в термине перманганатометрия?
9. Как используют заместительное титрование в йодометрии?
10. Какие вещества называют комплексонами?
Дата добавления: 2022-02-05; просмотров: 1160;











