V. Политропные процессы
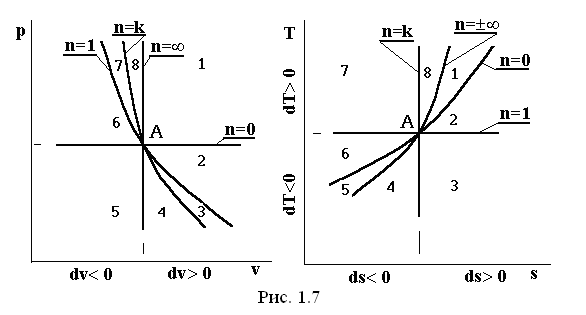
Выше было отмечено, что термодинамические процессы, которые описываются уравнением p×vn=const, называются политропными. В этом уравнении показатель политропы меняется в пределах -¥< n< +¥. Представим объединенную картину линий изопараметрических процессов в pv-, Ts-диаграммах, приняв за начало всех процессов (как в сторону расширения, так и в сторону сжатия) произвольную точку А. На этом рисунке приведены соответственно: изохора (n= ±¥), изобара (n=0), изотерма (n=1), адиабата (n=k). Эти изолинии делят координатную плоскость на 8 областей, в пределах каждой из которых все термодинамические процессы обладают общностью определенных свойств. Все процессы, начинающиеся в точке А, и происходящие в областях 1, 2, 3, 4, сопровождаются расширением рабочего тела (dv>0), следовательно, при этом совершается положительная работа δl=p×dv, а процессы, происходящие в областях 5, 6, 7 и 8 (dv<0), имеют отрицательную работу (в этих случаях работа совершается над системой внешними силами).
Процессы, совершающиеся в областях 1, 2, 3 и 8, протекают с подводом теплоты извне (ds>0), а в областях 4, 5, 6 и 7 - с отводом теплоты (ds<0).
Изотерма (n=1) делит рассматриваемое поле координатной плоскости на две части: в областях 1, 2, 7, 8 процессы протекают с повышением температуры (dT>0), а в областях 3, 4, 5, 6 процессы протекают с понижением температуры (dT<0). В области 3 между изотермой (n=1) и адиабатой (n=k) при подводе теплоты (ds>0), происходит падение температуры (dT<0), а при отводе теплоты (ds<0) в области 7 происходит повышение температуры (dT>0).
Все соотношения, вытекающие из уравнений политропных процессов p×vn=const; T×vn-1=const; Tn×p1-n=const, должны быть аналогичными соотношениям, вытекающим из соответствующих уравнений адиабатного процесса и получаются путем замены показателя адиабаты k на показатель политропы n. Однако при этом необходимо иметь в виду, что теплоемкость политропного процесса определяется по формуле 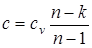 , а также теплота, участвующая в процессе, в этом случае определяется исходя из уравнения первого закона термодинамики
, а также теплота, участвующая в процессе, в этом случае определяется исходя из уравнения первого закона термодинамики
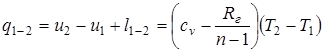 .
.
Перечень величин (1.37) в политропном процессе должен удовлетворять следующим соотношениям
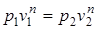 ; (1.67)
; (1.67)
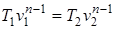 ; (1.68)
; (1.68)
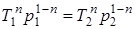 ; (1.69)
; (1.69)
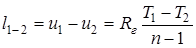 ; (1.70)
; (1.70)
Du= u2 - u1 =cv× (T2- T1); (1.71)
Dh= h2 - h1 =cp× (T2- T1); (1.72)
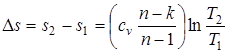 ; (1.73)
; (1.73)
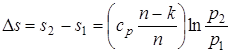 ; (1.74)
; (1.74)
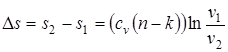 ; (1.75)
; (1.75)

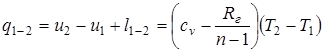 . (1.76)
. (1.76)
Вопросы для самопроверки
1. Что такое рабочее тело? Почему в качестве рабочего тела используются вещества в газообразном (парообразном) состоянии?
2. Что такое параметр состояния? Являются ли параметры состояния независимыми величинами?
3. В чем состоит взаимодействие между системой и окружающей средой?
4. Какие процессы называются равновесными и какие неравновесными?
5. Что такое термодинамическая поверхность?
6. Как вычисляется теплота и работа? Функциями чего являются эти величины?
7. Дайте определение внутренней энергии энтальпии и энтропии. Функцией чего являются эти величины?
8. Какие термодинамические диаграммы чаще всего применяют на практике и почему?
9. Чему равна площадь под кривой процесса на pv – диаграмме?
10. Сформулируйте первый закон термодинамики.
11. Запишите различные аналитические выражения первого закона термодинамики.
12. Какова история открытия первого закона термодинамики?
Дата добавления: 2021-07-22; просмотров: 1436;











