Cупрамолекулярная химия. Введение
Супрамолекулярная химия – одна из самых молодых и в то же время бурно развивающихся областей химии. За 40 лет своего существования она уже успела пройти ряд важных этапов, но в то же время основные идеи и понятия этой дисциплины еще не являются общеизвестными и общепринятыми.
Для появления нового отдельного раздела химии нужно было:
- обобщить накопленные знания
- инструменты изучения
- готовность научного сообщества принять данную идею
Термин «супрамолекулярная химия» и основные понятия этой дисциплины были введены нобелевским лауреатом французским ученым Жаном-Мари Леном в 1978 г. в рамках развития и обобщения более ранних работ (в частности, в 1973 г. в его трудах появился термин «супермолекула»). Супрамолекулярная химия определялась словами: «Подобно тому как, существует область молекулярной химии, основанной на ковалентных связях, существует и область супрамолекулярной химии, химии молекулярных ансамблей и межмолекулярных связей». Впоследствии это первое определение много раз переформулировалось. Пример другого определения, данного Леном: «супрамолекулярная химия – это «химия за пределами молекулы», изучающая структуру и функции ассоциаций двух или более химических частиц, удерживаемых вместе межмолекулярными силами».
Супрамолекулярная химия – междисциплинарная область науки, включающая химические, физические, биологические аспекты рассмотрения более сложных, чем молекулы, химических систем, связанных в единое целое посредством межмолекулярных (нековалентных) взаимодействий. Эта сравнительно молодая область оформилась как самостоятельное, целостное и одновременно хорошо структурированное направление со своими концепциями. Корнями Супрамолекулярная химия уходит: в органическую химию – науку о синтезе молекул; в координационную химию, изучающую комплексы ион металла – лиганд; в физическую химию, экспериментально и теоретически изучающую взаимодействия; в биохимию, рассматривающую биологические процессы, каждый из которых начинается с распознавания и связывания субстрата; в материаловедение и науку о механических свойствах твердых тел. Отличительная особенность супрамолекулярной химии – широкий спектр возможностей, открывающихся из-за взаимообогащения и "перекрестного опыления" химии, биологии, физики. Охватывая разнообразные явления из различных областей – от физики организованных конденсированных фаз до биологии больших молекулярных ансамблей.
Для того чтобы определить химические объекты, необходимо указать составляющие их элементы и типы связей между элементами, а также пространственные (геометрические, топологические) характеристики. Объекты супрамолекулярной химии, супермолекулы, обладают такой же определенностью, как и составляющие их отдельные молекулы. Можно сказать, что "супермолекулы представляют собой по отношению к молекулам то же, что молекулы по отношению к атомам, причем роль ковалентных связей в супермолекулах играют межмолекулярные взаимодействия" Таким образом, супермолекулы представляют собой следующий уровень сложности организации материи, после элементарных частиц, ядер, атомов и молекул. Проводя параллели с языком, можно сказать, что атомы, молекулы и супермолекулы – это "буквы", "слова" и "предложения" языка химии!
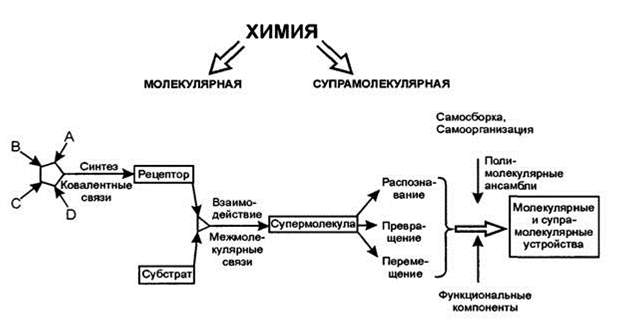
Поскольку термин "лиганд", используется в самых различных контекстах, компоненты супрамолекулярных ассоциатов было предложено называть рецептор (ρ) (гесерtоr) и субстрат (substrate), где субстрат (ы) — меньший (е) по размеру компонент (ы), вступающий (е) в связь. В этой терминологии нашла отражение связь супрамолекулярной химии с биологией, в которой значительное место занимает рассмотрение структурно и функционально определенных взаимодействий рецептор – субстрат. Данная терминология легко переносима из одного языка в другой. Термины соединение включения, клатрат и соединение типа гость – хозяин, характеризуют соединения, существующие только в твердом состоянии и не являющиеся в строгом смысле слова дискретными супермолекулами, хотя и относящиеся к твердым супрамолекулярным ансамблям.
Селективное связывание определенного субстрата и его рецептора с образованием супермолекулы происходит в результате процесса молекулярного распознавания (molecular recognition), являющегося высокоспецифичным процессом. Если помимо центров связывания рецептор содержит также реакционноспособные функциональные группы, он может влиять на химические превращения на связанном с ним субстрате, выступая в качестве супрамолекулярного реагента или катализатора. Липофильный, растворимый в мембранах рецептор может выступать в роли носителя (саrrier), осуществляя транспорт, перенос) связанного субстрата, например, через мембраны.
Таким образром, молекулярное распознавание, превращение, перенос — это основные функции супрамолекулярных объектов. Более сложные функции могут выполняться за счет скоррелированного действия одновременно нескольких фрагментов, участвующих в связывании.
Супрамолекулярную химию можно в таком случае разделить на две широкие, частично перекрывающиеся области, в которых рассматриваются соответственно:
1) супермолекулы–хорошо определенные, дискретные олигомолекулярные образования, возникающие за счет межмолекулярной ассоциации нескольких компонентов (рецептора и субстрата(ов)) в соответствии с некоторой "программой", работающей на основе принципов молекулярного распознавания;
2) супрамолекулярные ансамбли–полимолекулярные ассоциаты, возникающие в результате спонтанной ассоциации неопределенно большого числа компонентов в специфическую фазу, характеризуемую более или менее определенной организацией на микроскопическом уровне и макроскопическими свойствами, зависящими от природы фазы (пленка, слой, мембрана, везикула, мицелла, мезоморфная фаза, кристалл и т. д.).
Таким образом, супрамолекулярная химия охватывает и позволяет рассмотреть с единых позиций все виды молекулярных ассоциатов, от минимально возможного (димер) до наиболее крупных (организованных фаз).
Как происходит образование супрмолекулярных комплексов? Прежде всего, это самопроизвольные процессы: смешиваются растворы компонентов, которые самопроизвольно организуются в комплексы с определённой архитектурой. Так, в органическом растворителе происходит самопроизвольное образование комплекса, в котором катион металла связан с атомами кислорода и располагается внутри краун-эфирной полости.
В некоторых случаях образование комплексов требует протекания химической реакции. Так образуются известные комплексы, имеющие в своем составе полипиридиниевые лиганды и двух или трёхвалентный катион рутения.
В супрамолекулярной химии продукты самоорганизации имеют свои названия. Первые названия были клатраты («молекулы-хозяева» координируют субстрат во внутримолекулярных полостях), кавитаты («молекулы-хозяева» координируют субстрат в межмолекулярных полостях). В последнее время наиболее часто используется такие названия, как соединения включения, комплексы, ассоциаты, соединения типа «гость-хозяин», супрамолекулярные ансамбли.
На рис. представлены основные типы комплексов, возникающие между лигандом и субстратом. Образование того или иного комплекса определяется соотношением размеров лиганда и субстрата, а также природой и структурой координирующего центра.
Инклюзивный комплекс Комплекс-гнездо Комплекс-сэндвич Комплекс-клетка
За счёт каких сил происходит связывание молекул в ансамбли, сложные агрегаты? Это нековалентные связи, которыми являются электростатические взаимодействия, водородные связи, ван-дер-вальсовысилы, стэкинг-взаимодействие, координационные связи. Все межмолекулярные связи отличаются небольшими энергиями образования.
Образование нековалентных связей проявляется в увеличении температур плавления или кипения по сравнению с мономерной исходной молекулой, поскольку необходимо потратить энергию на разрушение межмолекулярных связи.
Большую роль при возникновении металлоорганических комплексов играет координационная связь (50-200кДж/моль). Иногда её называют также донорно-акцепторной связью. При образовании связи один из атомов является донором и имеет электронную пару на внешней оболочке. У акцептора должна быть одна вакантная орбиталь во внешней оболочке. В состав донора входят многие гетероатомы, среди них известными по способности образовывать координационные связи являются атомы кислорода, азота, серы. Акцептором может являться протон, катион металла.
Разновидностью координационных связей считают водородные связи.
При образовании водородных связей атомы водорода способны связываться с атомами кислорода, азота, реже фтора, хлора, серы. При этом высвобождающаяся энергия лежит в пределах 4-120кДж/моль, что заметно ниже химической связи. Роль водородной связи в природе велика. Так, вода, ассоциированная за счёт водородных связей, проявляет специфические свойства, что, в частности, обуславливает роль воды в природе и организмах живых существ.
Молекула имеет высокий дипольный момент, когда два разноименных заряда расположены на разных её концах. Дипольный момент определяется как зависимость величины заряда от длины молекулы, эту величину можно измерить. При межмолекулярном диполь-дипольном взаимодействии молекулы располагаются так, что положительные концы молекул ассоциируются с отрицательными концами. Энергия диполь-дипольного взаимодействия оценивается в 5-50кДж/моль. Например, известно образование агрегатов цианиновых красителей за счёт диполь-дипольного взаимодействия.
Силы притяжения и отталкивания могут возникнуть между нейтральными молекулами, не связанными непосредственно между собой. Они называются силами Ван-дер-Ваальса. Данные взаимодействия подразделяют на дисперсионные (силы Лондона) и обменно-отталкивающие. Любая нейтральная молекула под действием внешней среды может в некоторой степени поляризоваться и в поляризованном состоянии взаимодействовать с другой молекулой. Поляризуемость молекулы обусловлена возможностью деформации внешнего электронного облака. В силу пространственно сближенного расположения между поляризованными молекулами может возникнуть притяжение, сопровождающееся выделением энергии. Энергия такого взаимодействия оценивается в 5-20кДж/моль. Однако сближение молекул на расстояние ближе суммы ван-дер-ваальсовых радиусов приводит к их отталкиванию. Ван-дер-ваальсовый радиус есть половина расстояния между центрами атомов при наибольшем их сближении.
Наиболее сильно проявляются дисперсные силы в протяжённых молекулах, когда есть возможность многоцентрового взаимодействия. Так, высокая прочность полиэтилена объясняется взаимодействием между полимерными цепями за счёт сил Ван-дер-Ваальса. Комплексы каликсаренов с молекулами толуола являются типичными ван-дер-ваальсовыми комплексами.
В научной литературе можно найти описание ряда других слабых взаимодействий, используемых для построения супрамолекулярных ансамблей. Так, при получении моно- и полислоёв из органических молекул определяющую роль играют гидрофобные взаимодействия. Образование плёнок происходит за счёт выталкивания из воды слабо сольватированных гидрофобных молекул.
Вещества, имеющие в структуре как полярные, так и неполярные группы, называются амфифильными. К этой группе принадлежат, например, жиры, фосфолипиды и желчные кислоты.
Вследствие гидрофобных взаимодействий амфифилы при контакте с водой склонны образовывать структуры, у которых площадь контакта неполярной части молекул с водой минимальна. На поверхности воды такие вещества обычно образуют монослойные плёнки, у которых полярные группы ориентированы в воду. Мыльные пузырьки образованы липидными бислоями с тонким наружным слоем воды. В воде амфифилы образуют протяжённые бислойные мембраны или мицеллы, у которых полярные группы ориентированы в воду. По этому принципу построено большинство биологических мембран. Полые мембранные пузырьки носят название везикул. В клетках и крови такие структуры играют ключевую роль при выполнении транспортных функций.
- Стэкинг-взаимодействием называют слабое электростатическое взаимодействие с энергией связи 0-50кДж/моль, возникающее между кольцами электронно-насыщенного ароматического соединения и соединения, испытывающего недостаток электронной плотности.
Многочисленные экспериментальные данные по рентгеноструктурному анализу показали, что очень часто протяжённые ароматические или хромофорные системы организуются в стопки, в которых молекулы располагаются друг над другом за счёт стэкинг-взаимодействия.
Существуют два основных типа π- π-стэкинг-взаимодействия: «плоскость-к-плоскости» и «торец-к-плоскости». Стэкинг-взаимодействие «плоскость-к-плоскости» обусловлено в основном дисперсионными лондоновскими силами и гидрофобными эффектами. При таком взаимодействии молекулы располагаются параллельно друг другу на расстоянии ван-дер-ваальсового радиуса, приблизительно3-4Å.
Взаимодействие типа «торец-к-плоскости» можно рассматривать как водородные связи между электрон-дифицитными атомами водорода одного кольца и обогащённым электронным облаком другого. Взаимодействия такого вида обуславливают «ёлочную» упаковку в кристалле.
Многие из перечисленных взаимодействий, играющих важную роль в образовании супрамолекулярных систем, можно обнаружить в белках.
Первичная структура белка представляет собой последовательность аминокислот. Эта последовательность определяет строение белка. Вторичная структура белка образуется за счёт водородных связей между отдельными фрагментами полипептидной цепи.
С помощью рентгеноструктурного анализа было установлено, что стабилизация вторичной структуры белка происходит за счёт образования спирали, содержащей 4 аминокислоты на один виток, при участии - стэкинг- и гидрофобных взаимодействий. Такая структура может быть отнесена к супрамолекулярной структуре белка.
Распознавание является фундаментальным понятием супрамолекулярной химии. Связывание субстрата с рецептором (лигандом) происходит по определённым правилам, рецептор может выбирать субстрат, соответствующий его параметрам и природе. Молекула рецептора на своём молекулярном уровне хранит информацию, которая считывается на супрамолекулярном уровне. Информацией может служить размер, форма, конформация, хиральность, заряд, полярность, липо- или гидрофильность субстрата.
Термин «молекулярное распознавание» введён Э. Фишером в 1894 г. Он описал стерическое соответствие рецептор–субстрат по форме и геометрии в виде образа «замок–ключ».
Другим термином, используемым при описании супрамолекулярных структур, является комплементарность – взаимное соответствие, обеспечивающее связь дополняющих друг друга структур.
Образование супрамолекулы происходит при соблюдении ряда условий.
Пространственная комплементарность, т.е. возможность субстрату подойти к рецептору.
Комплиментарность на уровне возможности осуществления взаимодействия. Так, если рецептор положительно заряжен, то субстрат должен обладать отрицательным зарядом. Донор взаимодействует с акцептором, диполь - с диполем.
Стабильность молекулярных ансамблей. Поскольку межмолекулярные взаимодействия являются слабыми, то множественность взаимодействий обеспечивает прочность межмолекулярным ансамблям.
Эффект растворителя. Важно учитывать эффект среды, поскольку межмолекулярные связи не должны разрушаться при взаимодействии со средой.
Распознавание предполагает комплементарность партнеров – геометрическое (размер полости, например), природное соответствие.
Предорганизация. Если молекула не подвергается значительным конформационным изменениям при связывании «гостя», то считается, что она предорганизована к процессу комплексообразования. В случае гибких рецепторов требуется предорганизация рецептора для процесса связывания катиона. Процесс комплексообразования проходит в две стадия. На первой стадии происходит конформационная перестройка рецептора, которая требует затрат энергии, на второй стадии – координации субстрата происходит выделение энергии. Жёсткие рецепторы не требуют конформационной перестройки, процесс комплексообразования с такими рецепторами проходит медленно. Конформационно подвижные (гибкие) рецепторы быстро образуют комплексы, также и разрушение комплексов происходит достаточно быстро.
Основные различия в гибких и жёстких рецепторах:
размер полости жёсткого рецептора фиксирован;
положение заместителей жёсткого рецептора фиксировано;
селективность связывания жёсткого рецептора выше по сравнению с гибким аналогом.
Рецепторы делятся на эндорецепторы, втягивающие субстрат внутрь своей полости, и экзорецепторы, в которых связывающие центры находятся снаружи.
Важной характеристикой рецептора является количество разных по природе центров координации. Так, различают монотопные рецепторы, дитопные и политопные, имеющие несколько одинаковых или различных по природе мест связывания субстрата.
Последние достижения в супрамолекулярной химии и наиболее перспективные области ее использования связаны с процессами молекулярного распознавания и образования новых структур за счет так называемых самопроцессов. Понятия самосборки self-assembling и самоорганизации self-organization были введены в супрамолекулярную химию Ж М. Леном в ходе изучения спонтанного образования неорганических комплексов двойных геликатов, протекающего как процесс самосборки. По сути, эти понятия пришли в супрамолекулярную химию из биохимии, где они еще раньше заняли важное место, поскольку только за счет самопроцессов может осуществляться биосинтез.
Наиболее яркое проявление самосборки в живой природе самосборка молекул нуклеиновых кислот, матричный синтез белков на определяющую роль самосборки указывает строго определенная пространственная структура ферментов и рецепторов. В супрамолекулярной химии самоорганизация означает спонтанную генерацию при заданных условиях хорошо определенной супрамолекулярной структуры из отдельных составных компонентов. Согласно Лену, самосборка и самоорганизация описывают два различных, но частично перекрывающихся класса явлений, причем самосборка это более широкий термин, чем самоорганизация. Супрамолекулярная самосборка заключается в спонтанной ассоциации как минимум двух или более компонентов, приводящей к образованию или дискретных супермолекул, или протяженных полимолекулярных ансамблей молекулярные слои, пленки и т.д. При этом процесс ассоциации происходит за счет нековалентных взаимодействий. Самоорганизацию Лен определяет как упорядоченную самоассоциацию, которая 1 включает системы, в которых возможно спонтанное возникновение порядка в пространстве и/или во времени, 2 охватывает пространственный структурный и временной динамический порядок, 3 затрагивает только супрамолекулярный нековалентный уровень, 4 является многокомпонентной.
Таким образом, самоорганизация включает взаимодействие и интеграцию, обусловливающие коллективное поведение. Самоорганизация может происходить в растворе, в жидкокристаллической фазе или твердом состоянии, причем в качестве основных взаимодействий между компонентами используются водородные связи, электростатические и донорно-акцепторные взаимодействия, а также эффекты среды сольвофобные взаимодействия.
| <== предыдущая лекция | | | следующая лекция ==> |
| Введение в экологию | | |
Дата добавления: 2020-12-11; просмотров: 1594;











