Периодическая система элементов Д.И. Менделеева
Рабочая программа. Периодический закон Менделеева – один из основных законов природы. Современное определение понятий порядкового номера элемента, периода, группы. Физический смысл периодического закона. Построение системы элементов на основе электронных структур атомов элементов. Понятие об s-, p-, d- и f- элементах. Структура периодической системы: периоды, группы, подгруппы. Изменение свойств элементов, их соединений и простых веществ по периодам и группам. Периодические свойства атомов: энергия ионизации, сродство к электрону, электроотрицательность, радиус.
Периодический закон Д.И. Менделеева формулируется следующим образом: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов.
Заряд ядра определяет число электронов, а следовательно, электронные структуры атомов в невозбужденном состоянии (табл. 5.2).
Водород, первый элемент периодической системы (ПС), имеет заряд ядра, равный единице. В соответствии с принципом наименьшей энергии единственный электрон атома водорода располагается на 1s-подуровне. Строение электронной оболочки атома водорода может быть описано электронной формулой 1s1, означающей, что электрон располагается на оболочке с главным квантовым числом n=1 (К-уровень) и побочным квантовым числом l=0 (s-подуровень). Строение электронной оболочки атома водорода может быть представлено графически с помощью квантовой ячейки:
| ↑ |
Атом гелия имеет заряд ядра, равный двум. В соответствии с принципом наименьшей энергии, запретом Паули и правилом Гунда два электрона атома гелия будут располагаться на 1s-подуровне и иметь противоположные спины (спаренные электроны). Электронная конфигурация атома гелия будет описываться электронной формулой 1s2 и может быть изображена графически следующим образом:
|
Подуровень 1s и уровень К заполнены полностью. Одновременно окончено заполнение 1-го периода ПС.
|
Второй период заканчивается благородным газом неоном, имеющим конфигурацию 2s22p6. Электронная структура ns2np6 называется благородногазовой конфигурацией. Она обладает высокой устойчивостью в химических реакциях. Эта конфигурация (2s22p6) сохраняется у всех последующих элементов и обозначается как [Ne].
Элементы, у которых происходит заполнение s-подуровня, называют s-элементами, а р-подуровня – р-элементами. К s-элементам относятся H, He, Li, Be, а B, C, N, O, F – р-элементы. Эти элементы являются первыми элементами восьми главных подгрупп ПС.
Таблица 5.2. Электронные конфигурации атомов элементов
| Период | Порядковый номер | Элемент | Электронная конфигурация |
| H He | 1s1 1s2 | ||
| Li Be B С N O F Ne | [He]2s1 2s2 2s22p1 2s22p2 2s22p3 2s22p4 2s22p5 2s22p6 | ||
| Na Mg Al Si P S Cl Ar | [Ne] 3s1 3s2 3s23p1 3s23p2 3s23p3 3s23p4 3s23p5 3s23p6 | ||
| K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr | [Ar]4s1 4s2 3d14s2 3d24s2 3d34s2 3d54s1 3d54s2 3d64s2 3d74s2 3d84s2 3d104s1 3d104s2 3d104s24p1 3d104s24p2 3d104s24p3 3d104s24p4 3d104s24p5 3d104s24p6 |
Продолжение табл. 5.2
| Период | Порядковый номер | Элемент | Электронная конфигурация |
| Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe | [Kr]5s1 5s2 4d15s2 4d25s2 4d45s1 4d55s1 4d55s2 4d75s1 4d85s1 4d105s0 4d105s1 4d105s2 4d10 5s25p1 4d10 5s25p2 4d10 5s25p3 4d10 5s25p4 4d10 5s25p5 4d10 5s25p6 | ||
| Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu | [Xe]6s1 6s2 5d16s2 4f2 6s2 4f3 6s2 4f4 6s2 4f5 6s2 4f6 6s2 4f7 6s2 4f75d16s2 4f9 6s2 4f106s2 4f116s2 4f126s2 4f136s2 4f146s2 4f145d16s2 |
Окончание табл.5.2
| Период | Порядковый номер | Элемент | Электронная конфигурация |
| Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn | 4f145d26s2 4f145d36s2 4f145d46s2 4f145d56s2 4f145d66s2 4f145d76s2 4f145d96s1 4f145d106s1 4f145d106s2 4f145d106s26p1 4f145d106s26p2 4f145d106s26p3 4f145d106s26p4 4f145d106s26p5 4f145d106s26p6 | ||
| Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db | [Rn]7s1 7s2 6d17s2 6d27s2 5f26d17s2 5f36d17s2 5f46d17s2 5f67s2 5f77s2 5f76d17s2 5f86d17s2 5f107s2 5f117s2 5f127s2 5f137s2 5f147s2 5f146d17s2 6d27s2 6d37s2 |
Третий период начинается так же, как и второй, с s1-элемента – натрия, а заканчивается s2p6-элементом – аргоном. Из электронных формул, приведенных в табл. 5.2, следует, что элементы, находящиеся в одной и той же главной подгруппе ПС, имеют аналогичное строение внешней электронной оболочки. Это сходство ведет к сходству химических свойств элементов, расположенных в одной подгруппе одной группы. В третьем периоде третий электронный уровень M остается незаполненным, т.к. 3d-подуровень свободен.
В соответствии с принципом наименьшей энергии четвертый период начинается с заполнения 4s-подуровня, как имеющего более низкую энергию по сравнению с 3d-подуровнем. После заполнения у кальция 4s-подуровня начинается заполнение 3d-подуровня у скандия. Элементы от скандия [Ar]3d14s2 до цинка [Ar]3d104s2, у которых происходит заполнение d-подуровня, относятся к электронному семейству d-элементов. Они являются также первыми элементами побочных подгрупп ПС. Очевидно, что все d-элементы находятся в побочных подгруппах.
В атоме хрома наблюдается переход одного электрона с уже заполненного 4s2-подуровня на 3d-подуровень, и на 3d-подуровне оказываются не четыре, а пять электронов. Это явление носит название провал (проскок) электрона и объясняется более низкой энергией конфигурации d5s1 по сравнению с d4s2. Провал электрона имеет место у целого ряда элементов (Cu, Nb, Mo, Tc, Ru, Rh, Pd, Ag, La, Gd и др.).
Заполнение пятого периода аналогично заполнению четвертого периода.
Шестой период начинается с заполнения s-подуровня у цезия и бария. Следующий электрон поступает на 5d-подуровень лантана. Однако у следующих четырнадцати элементов происходит заполнение 4f-подуровня, что энергетически более выгодно. Эти элементы принадлежат к f-семейству и носят название лантанидов. За лантанидами следуют десять d-элементов и шесть р-элементов. Завершается период благородным газом. Таким образом, шестой период состоит из 32 элементов.
Заполнение седьмого периода аналогично шестому, с той лишь разницей, что к настоящему времени период не завершен.
Отсюда следует, что с ростом заряда ядра происходит образование периодически повторяющихся, сходных электронных структур, а значит, и повторяемость свойств элементов.
Структура периодической системы.Известно несколько сотен вариантов представления ПС. Наиболее распространенными являются короткопериодный (восьмиклеточный; предложенный Менделеевым) (см. табл. 1.4) и длиннопериодный (восемнадцатиклеточный) варианты.
Периодическая система состоит из семи периодов и восьми групп. Периоды начинаются s-элементом, имеющим электронную структуру ns,1 и заканчиваются p-элементом с электронной структурой ns2np6, где n не только главное квантовое число, но и номер периода. Исключением является первый период, который заканчивается элементом с электронной структурой 1s2. Периоды подразделяются на три малых и четыре больших периода. Первый период содержит 2 элемента, второй и третий по 8 элементов. Четвертый и пятый периоды содержат по 18 элементов, шестой – 32. Последний, седьмой, период не завершен. Малые периоды состоят из s- и р-элементов, четвертый и пятый большие периоды включают в себя также d-элементы, а шестой и седьмой периоды содержат s-, p-, d- и f-элементы.
Группы делятся на главные и побочные подгруппы, обозначаемые буквами А и В. Подгруппы содержат элементы с аналогичными электронными структурами внешнего уровня, а в случае d-элементов – на внешнем s и заполняющемся d подуровнях. Главные подгруппы начинаются с элементов первого и второго периодов. Главные подгруппы первой и второй групп состоят из s-элементов, а от третьей до восьмой – из р-элементов. Побочные подгруппы состоят из d-элементов за исключением IIIB-подгруппы, которая содержит также f-элементы. В короткопериодном варианте ПС f-элементы (лантаниды и актиниды) вынесены из III группы побочной подгруппы шестого и седьмого периодов и помещены отдельно.
Периодичность изменения свойств элементов.Свойства элементов и их соединений могут быть разделены на периодически изменяющиеся и не изменяющиеся периодически. Свойства элементов, определяемые строением электронных оболочек атомов, закономерно изменяются по периодам и группам ПС. При этом в каждом последующем периоде свойства элементов не просто повторяются, но наблюдается b[ закономерное изменение. Из большого числа периодических свойств рассмотрим энергию ионизации, сродство к электрону, электроотрицательность и атомные радиусы.
Энергия ионизации атома.Энергия, необходимая для отрыва электрона от невозбужденного атома, называется первой энергией (потенциалом) ионизации I:
Э + I = Э+ + е-.
Энергии, необходимые для отрыва второго, третьего и последующих электронов, носят название второй (I2), третьей (I3) и т.д. энергий (потенциалов) ионизации. Энергия ионизации выражается в килоджоулях на моль (кДж/моль) или электронвольтах на моль (эВ/моль). Увеличение положительного заряда образовавшегося иона ведет к росту энергии ионизации ( I1<I2< <I3…).
Энергия ионизации возрастает в периодах от щелочных металлов к благородным газам и уменьшается в группах сверху вниз (рис. 5.3). Наименьшие энергии ионизации имеют щелочные металлы, начинающие периоды, а наибольшие – благородные газы, заканчивающие периоды. Пики на кривой рис. 5.3 соответствуют полностью законченной s-оболочке (Be, Mg) или наполовину заполненной р-оболочке (N, P). Энергии ионизации элементов, находящихся в главной подгруппе одной и той же группы, уменьшаются с увеличением порядкового номера элемента. Для d- и f-элементов закономерности более сложные.
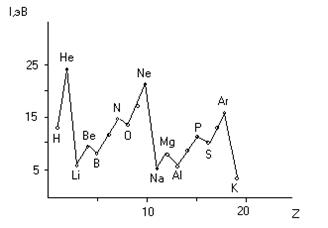
Рис. 5.3. Зависимость первой энергии ионизации от порядкового номера элемента Z
Сродство к электрону. Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону (Е):
Э + е- = Э- - Е.
Сродство к электрону выражается в тех же единицах, что и энергия ионизации.
Для элементов главных подгрупп сродство к электрону возрастает в периодах слева направо и уменьшается в группах сверху вниз. Максимальное значение сродства к электрону имеет фтор.
Электроотрицательность. Способность атома, находясь в составе устойчивой молекулы, смещать к себе электронную плотность характеризуется электроотрицательностью. Существует много способов количественной оценки электроотрицательности. Так, электроотрицательность по Малликену (χ) равна полусумме энергии ионизации и сродства к электрону:
χ = ½ (I + Е).
Для s- и р-элементов электроотрицательность возрастает в периодах слева направо и уменьшается в группах сверху вниз. Минимальное значение сродства к электрону имеет франций, а максимальное – фтор.
Атомные радиусы. Из квантово-механических представлений о характере движения электрона следует, что атом не имеет определенных границ. По этой причине за атомные радиусы принимают величины, найденные на основе тех или иных допущений. Численные значения радиусов, определенные на основе разных подходов, не совпадают между собой. Теоретически рассчитывают так называемые орбитальные радиусы, или расстояние от центра ядра до наиболее удаленного от него максимума электронной плотности. Экспериментально величины атомных радиусов могут быть определены, например, как половина расстояния между центрами двух соседних атомов в кристалле простого вещества (эффективные радиусы).
Периодичность изменения атомных радиусов особенно отчетливо выражена у s- и р-элементов: в периодах слева направо радиусы уменьшаются, а в группах сверху вниз увеличиваются. Закономерности изменения атомных радиусов для d- и f-элементов имеют более сложный характер.
Вопросы для самостоятельной подготовки
1. Сформулируйте периодический закон Д.И. Менделеева.
2. Опишите структуру короткопериодного варианта ПСЭМ.
3. Чем обусловлена периодичность изменения свойств химических элементов?
4. В чем основное различие свойств элементов главных и побочных подгрупп?
5. На что указывает номер группы в ПСЭМ?
6. Чем определяется принадлежность химического элемента к тому или иному электронному семейству?
7. Найдите в периодической системе элемент, в атоме которого завершается заполнение электронами 3-го квантового уровня. Напишите электронную формулу атома этого элемента.
8. Какое из следующих состояний описывается электронной конфигурацией 1s22s22p53s1:
а) возбужденное состояние атома фтора;
б) основное состояние неона;
в) возбужденное состояние аниона кислорода О2-;
г) основное состояние аниона фтора F-?
9. Одинаково ли электронное строение атомов изотопов одного и того же элемента?
9. Составьте электронную конфигурацию ионов: 1)H‾; 2) Al3+; 3) Cl‾.
10.Как изменяется значение сродства к электрону в периодах ПСЭМ?
11. Как изменяется значение сродства к электрону в подгруппах?
12. Как изменяется значение энергии ионизации в периодах ПСЭМ?
13. Как изменяется значение энергии ионизации в подгруппах ПСЭМ?
14. Как изменяется электроотрицательность элементов в периодах и группах ПСЭМ?
15. Для каких элементов 3-го периода различие электроотрицательностей будет максимальным?
16. Как изменяются значения атомных радиусов в подгруппах ПСЭМ?
17. Как соотносятся между собой радиусы следующих частиц: а)Н, Н+ и Н-; б) Cl, Cl+ и Cl-?
5.6.Задания для текущих и промежуточных контролей
1. Чем обусловлена периодичность изменения свойств элементов?
2. Элементы с какими свойствами начинают и с какими свойствами заканчивают любой период?
3. В чем заключается принципиальное различие между элементами главных и побочных подгрупп?
4. Какова основная тенденция изменения радиусов элементов главных подгрупп в пределах периода с увеличением заряда ядра атомов?
5. Как изменяются энергия ионизации, энергия сродства к электрону, электроотрицательность элементов главных подгрупп в пределах периода с увеличением заряда ядра атомов?
6. Как изменяются энергии ионизации и сродства к электрону, электроотрицательность s- и p - элементов в пределах подгрупп с увеличением заряда ядра?
7. Какие элементы ПСЭМ имеют наибольшие и наименьшие значения энергий ионизации и сродства к электрону, электроотрицательности?
8. Как изменяются металлические и неметаллические свойства элементов главных подгрупп в пределах периода и в пределах подгрупп с увеличением заряда ядер атомов?
9. Какие из s-элементов в виде простых веществ являются: а) газообразными неметаллами; б) металлами?
10. Свойства лантанидов очень близки. В чем причина?
11. Для каких элементов 3-го периода различие энергий ионизациибудет максимальным? Почему?
12. Какие из следующих элементов образуют оксиды с формулой Э2О3: Ca, Cd, In, Cs, Ga, P? Аргументируйте ответ.
13. Какие из следующих элементов образуют гидроксиды с формулой Э(ОН)2: Rb, Sr, C, Se, As, Zn? Аргументируйте ответ.
14. Какой из следующих элементов имеет наибольший атомный радиус: К, Al, Cs, Ba, Te, Br? Аргументируйте ответ.
15. Дайте мотивированный ответ на вопрос: какие элементы легче образуют катионы, а какие анионы?
16. Расположите элементы в порядке возрастания их неметаллических свойств: As, Se, F, Cl, Br.
17. Энергия ионизации в процессе Mg1+ ® Mg2+ + 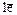
 вдвое превышает энергию ионизации в процессе Mg ® Mg1+ +
вдвое превышает энергию ионизации в процессе Mg ® Mg1+ + 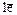 . При удалении третьего электрона требуется в десять раз больше затрат энергии, чем при удалении первого. В чем причина такого резкого отличия?
. При удалении третьего электрона требуется в десять раз больше затрат энергии, чем при удалении первого. В чем причина такого резкого отличия?
18. Энергия ионизации в процессе 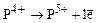 равна 6270 кДж/моль. Энергия ионизации в процессе
равна 6270 кДж/моль. Энергия ионизации в процессе 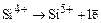 равна 16100 кДж/моль. В чем причина столь большого различия?
равна 16100 кДж/моль. В чем причина столь большого различия?
19. Как отличаются друг от друга энергии ионизации атомов: а) Na и Cl, б) K и Kr, в) Ве и Ва? Ответ обоснуйте.
20. Ион Li2+ и атом водорода имеют по одному 1s1-электрону. Различны или одинаковы энергии ионизации этих частиц?
21. Объясните, почему гелий, неон и аргон в отличие от криптона, ксенона и радона не образуют химических соединений.
22. Какой вывод можно сделать о свойствах элемента по значению его энергии ионизации и сродства к электрону?
23. Ионы Li+ и Н- имеют одинаковое число электронов. Энергия ионизации какого иона больше? Почему?
24. В чём особенность третьей группы ПСЭМ по сравнению с другими группами?
25. У каких элементов происходит заполнение второго снаружи электронного уровня?
26. У каких элементов происходит заполнение третьего снаружи электронного уровня?
27. Объясните, почему гелий, неон и аргон в отличие от криптона, ксенона и радона не образуют химических соединений?
28. Расположите частицы V2+, V3+, V4+,V5+ в порядке увеличения ионных радиусов. Ответ поясните.
29. Почему фтор в отличие от хлора, брома и йода не способен отдавать электроны?
30. Для элементов 2-го и 3-го периодов главных подгрупп
имеет место так называемое «диагональное сходство», состоящее в близости многих свойств элементов, расположенных в ПСЭМ по диагонали, например литий и магний, бериллий и алюминий и т.д. Как можно объяснить это явление?
Дата добавления: 2016-10-07; просмотров: 4862;











