Характеристики химической связи.
Длина связи – расстояние между центрами ядер в молекуле. Она может быть очень точно определена различными экспериментальными методами. Длина связи является величиной, характерной для данного типа связи, и мало изменяется при переходе от одного соединения к другому. Так, длина простой связи С-С колеблется в органических соединениях от 0,154 до 0,158 нм. Изменение типа связи сопровождается изменением ее длины. Например, lС-С≈0,154 нм, lС=С≈0,134 нм, а lС≡С ≈0,120 нм. Экспериментальное определение длины связи дает информацию о типе связи.
Энергия связи –энергия, затрачиваемая для разрыва одного моля связей данного типа и удаления атомов на такое расстояние, при котором их взаимодействием можно пренебречь. Энергия связи, как и длина, определяется типом связи и слабо зависит от природы конкретного соединения. Величины энергий связи определяют экспериментально различными методами (калориметрия, спектроскопия и др.). Чем больше энергия связи, тем устойчивее молекулы. Увеличение энергии связи сопровождается одновременным уменьшением ее длины, например, ЕС-С≈348, ЕС=С≈614, а ЕС≡С ≈849 кДж/моль. Это явление объясняется увеличением степени перекрывания электронных облаков при переходе от одинарной к двойной и тройной связям.
Направленность связи – свойство ковалентных связей быть ориентированными определённым образом в пространстве. Направленность ковалентных связей определяется типом гибридицации и соотношением числа связывающих и несвязывающих электронных пар.
Насыщаемость связи – это свойствоатома элемента образовывать определенное число ковалентных химических связей, зависящее от числа электронов на внешних подуровнях и числа вакантных орбиталей, которые могут быть использованы для образования связей. Если атом образует максимально возможное число связей, то связь носит название насыщенной, в ином случае связь является ненасыщенной.
Координационное число –число атомов или других структурных элементов, непосредственно связанных с центральным атомом. В соединениях с ковалентной связью координационное число равно числу гибридных орбиталей, используемых атомом для образования связей. Наиболее распространенными координационными числами являются 4 и 6. Например, координационное число азота и серы в ионах 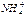 и
и 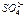 равно четырем. Координационное число увеличивается в подгруппах сверху вниз, что связано с участием в образовании гибридных орбиталей элементов больших периодов d- и f- атомных орбиталей и увеличением радиусов атомов.
равно четырем. Координационное число увеличивается в подгруппах сверху вниз, что связано с участием в образовании гибридных орбиталей элементов больших периодов d- и f- атомных орбиталей и увеличением радиусов атомов.
Полярность связи. Если химическая связь образована атомами с одинаковой электроотрицательностью, то максимум электронной плотности расположен симметрично относительно ядер, например Н−Н, О=О, N≡N. В ином случае максимум электронной плотности будет смещен в сторону ядра более электроотрицательного элемента и связь будет полярной. Чем больше разность электроотрицательностей элементов, образующих связь, тем сильнее выражена полярность связи.
Смещение максимума электронной плотности от положения равновесия приводит к появлению на более электроотрицательном атоме некоторого эффективного отрицательного заряда δ-. Одновременно на менее электроотрицательном атоме образуется равный по величине эффективный положительный заряд δ+. В результате возникает диполь, т.е. электрически нейтральная система, состоящая из равных по величине положительного и отрицательного зарядов. Расстояние между центрами тяжести положительного и отрицательного зарядов называется длиной диполя l.
Количественной мерой полярности связи является электрический момент диполя,или дипольный момент(μ), т.е. произведение эффективного заряда на длину диполя:
μ= δ l Кл•м.
В качестве единицы дипольного момента ранее часто использовался дебай (D): 1 D=3,33•10-30 Кл.м.
Длина диполя обычно меньше длины химической связи и уменьшается с уменьшением полярности связи. Так, в молекуле HF длина связи – 0,92 нм, дипольный момент – 1,86 D, а длина диполя – 0,40 нм, а для молекулы HI соответствующие величины имеют значения 1,62 нм, 0,38 D и 0,08 нм.
Дипольный момент является величиной векторной. Поэтому дипольный момент молекулы, содержащей несколько полярных связей, определяется как векторная сумма дипольных моментов всех связей. В результате молекула, образованная полярными связями, может быть неполярной. Например, молекула BeF2 содержит две полярные связи Be−F. В молекуле реализуется sp-гибридизация, следовательно, молекула имеет линейное строение, векторная сумма дипольных моментов равна нулю и молекула неполярна. В то же время молекула воды также содержит две полярные связи Н−О, но молекула имеет угловое строение (sp3-гибридизация с двумя несвязывающими парами). В результате векторная сумма дипольных моментов связей не равна нулю и молекула воды является высокополярным веществом (μ=1,83 D).
Большие различия в электроотрицательностях атомов, образующих связь, могут вести к переходу общей электронной пары к более электроотрицательному атому с образованием положительно и отрицательно заряженных ионов. В результате ковалентная полярная связь превращается в ионную связь. Связь между атомами осуществляется за счет электростатического кулоновского взаимодействия. Эти силы являются ненаправленными и ненасыщенными, следовательно, и ионная связь не обладает свойствами направленности и насыщаемости.
В действительности полного перехода электронной пары от одного атома к другому не происходит, чисто ионная связь не образуется и реальные, или эффективные,заряды ионов имеют дробную величину. Например, заряды ионов кальция и кислорода в ионном соединении СаО составляют соответвенно +0,8 и -0,8, а не +2 и -2, как можно было бы ожидать.
Поляризуемость связи –это способностьэлектронного облака в межъядерном пространстве деформироваться под действием внешнего электрического поля, создаваемого, например, соседними молекулами. Результатом поляризации химической связи может быть изменение ее полярности вплоть до разрыва связи с переходом общей электронной пары к одному из атомов и образованием катиона и аниона. Например, в молекуле хлористого водорода химическая связь полярная. В водном растворе под действием высокополярных молекул воды происходит поляризация связи H−Cl, сопровождающаяся ее разрывом и образованием ионов Н+ и Cl-.
Кратность связи – взаимное перекрывание электронных орбиталей в пространстве, осуществляемое различными способами в зависимости от формы орбиталей и их взаимной ориентации в пространстве.
Связь, образованная перекрыванием атомных орбиталей вдоль линии, связывающей ядра атомов, называется σ-связью. Эта связь может быть образована s-, p-, d- и f-орбиталями (рис. 6.7).
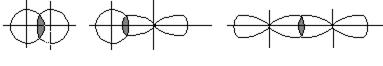
а) б) в)
Рис.6.7. Перекрывание атомных орбиталей при образовании σ-связей: а – s-s-связь; б – s-p-связь; в – р-р-σ-связь
Связь, образованная перекрыванием атомных орбиталей вдоль линии, перпендикулярной к линии, связывающей ядра атомов, называется π-связью. Эта связь может быть образована p-, d- и f-орбиталями (рис. 6.8).
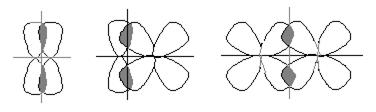
а) б) в)
Рис. 6.8. Перекрывание атомных орбиталей при образовании π-связей: а – p-p-связь; б – p-d-связь; в – d-d-π-связь
Связь, образованная перекрыванием атомных орбиталей в плоскости, перпендикулярной к линии, связывающей ядра атомов, называется δ-связью. Эта связь может быть образована d- и f-орбиталями (рис. 6.9).
Степень перекрывания уменьшается от σ- к π- и δ-связи. В этом же порядке уменьшается и прочность связи.
Между двумя атомами возможно образование не только одной, но и двух, и трех связей. Число связей между атомами называется кратностью связи. Двойные и тройные связи образуются при сочетании σ- и π-связей.
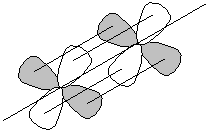
Рис. 6.9. Перекрывание атомных орбиталей при образовании d-d-δ-связи
Примером соединения с двойной связью является этилен С2Н4. Двойная связь между атомами углерода осуществляется одной σ- и одной π-связью (рис. 6.10). Увеличение кратности связи приводит к уменьшению длины связи от 0,154 до 0,134 нм при одновременном увеличении энергии связи от 348 до 614 кДж/моль.
Тройная связь за счет одной σ- и двух π-связей имеет место в молекулах азота и ацетилена.
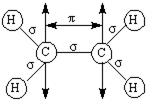
Рис. 6.10. Схема σ- и π-связей в молекуле этилена
Делокализованные связи. В молекуле этилена σ- и π-электроны принадлежат атомам, образующим химическую связь. В этом случае электроны и, соответственно, связь называют локализованными. Известно большое число соединений, в молекулах которых π-электроны могут свободно перемещаться между несколькими атомами. При этом электроны и образуемые ими химические связи являются делокализованными. Делокализованные π-связи имеют место как в неорганических, так и в органических соединениях.
Рассмотрим в качестве примера неорганического соединения с делокализованными π-связями нитрат-ион 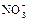 . Нитрат-ион имеет плоское строение. Три электрона атома азота образуют с тремя электронами атомов кислорода три гибридные sp2-связи, лежащие в одной плоскости. Угол между связями составляет 120о. Другие электроны атома азота, атомов кислорода и электрон атома водорода образуют делокализованные π-связи, распространяющиеся на атом азота и три атома кислорода. Об этом говорит тот факт, что в нитрат-ионе все три связи эквивалентны и их длина составляет 0,121 нм, тогда как длина одинарной связи N-O составляет 0,136 нм, а двойной связи N=O – 0,112 нм. Наличие делокализованной π-связи в
. Нитрат-ион имеет плоское строение. Три электрона атома азота образуют с тремя электронами атомов кислорода три гибридные sp2-связи, лежащие в одной плоскости. Угол между связями составляет 120о. Другие электроны атома азота, атомов кислорода и электрон атома водорода образуют делокализованные π-связи, распространяющиеся на атом азота и три атома кислорода. Об этом говорит тот факт, что в нитрат-ионе все три связи эквивалентны и их длина составляет 0,121 нм, тогда как длина одинарной связи N-O составляет 0,136 нм, а двойной связи N=O – 0,112 нм. Наличие делокализованной π-связи в 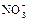 представлено на структурной формуле штриховой линией:
представлено на структурной формуле штриховой линией:
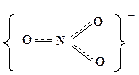
Делокализованные π-связи характерны для многих анионов неорганических кислородсодержащих кислот, например 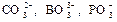 и др.
и др.
Дата добавления: 2016-10-07; просмотров: 5128;











