Метод молекулярных орбиталей
Рабочая программа. Метод молекулярных орбиталей. Молекулярная орбиталь как линейная комбинация атомных орбиталей. Понятие о связывающих и разрыхляющих молекулярных орбиталях. Порядок связи. Последовательность увеличения энергии молекулярных орбиталей элементов 1-го и 2-го периодов ПСЭМ. Электронные формулы молекул. Принципы заполнения молекулярных орбиталей. Молекулярные диаграммы двухатомных гомо - и гетероядерных молекул. Магнитные свойства молекул (диамагнетизм и парамагнетизм).
Метод валентных связей позволяет во многих случаях объяснить образование химической связи и предсказать целый ряд свойств молекул. Тем не менее известно много соединений, существование и свойства которых не могут быть объяснены с позиций метода ВС. Более универсальным является метод молекулярных орбиталей (МО).
Метод ВС основан на идее образования химической связи парой электронов, принадлежащей двум атомам. Согласно методу МО электроны, образующие химическую связь, движутся в поле, образуемом ядрами всех атомов, составляющих молекулу, т.е. электроны принадлежат всем атомам молекулы. Следовательно, молекулярные орбитали являются в общем случае многоцентровыми.
Согласно методу МО все электроны данной молекулы, участвующие в образовании химической связи, распределяются по соответствующим молекулярным орбиталям. Каждая молекулярная орбиталь, как и атомная орбиталь, характеризуется своим набором квантовых чисел.
Молекулярные орбитали получают сложением или вычитанием исходных атомных орбиталей. Если МО образуется из атомных орбиталей ψА и ψВ, то при их сложении возникает МО ψ+, а при вычитании – ψ- :
ψ+ = с1ψА + с2ψВ,
ψ- = с3ψА – с4ψВ,
где с1 – с4 – коэффициенты, определяющие долю участия соответствующей атомной орбитали в МО.
Эта операция носит название линейной комбинации атомных орбиталей, поэтому метод носит название МО ЛКАО(молекулярная орбиталь есть линейная комбинация атомных орбиталей). Число образующихся МО равно числу исходных АО. Молекулярные орбитали образуются только из атомных орбиталей с близкими энергиями. Большие различия в энергиях исходных АО препятствуют образованию МО. Орбитали внутренних энергетических уровней не участвуют в образовании МО.
При сложении АО образуются связывающие МО с энергией, меньшей, чем у исходных АО. Вычитание АО ведет к образованию разрыхляющих МО, имеющих более высокую энергию по сравнению с исходными АО. Схема образования связывающих и разрыхляющих МО из 1s атомных орбиталей приведена на рис. 6.11.
Электроны, находящиеся на МО, характеризуются четырьмя квантовыми числам
n – главное квантовое число;
l – орбитальное квантовое число;

Рис. 6.11. Схема образования связывающей (σ1s) и разрыхляющей (σ*1s) молекулярных орбиталей
λ – молекулярное квантовое число, аналогичное магнитному квантовому числу ml; может принимать значения 0; ±1;±2, обозначаемые буквами σ, π, δ соответственно;
ms – спиновое квантовое число.
Заполнение молекулярных орбиталей электронами подчиняется принципу Паули, принципу наименьшей энергии и правилу Гунда.
Последовательность увеличения энергий МО, т.е. последовательность заполнения, для элементов начала 2-го периода (для азота включительно) имеет вид
σ1s<σ*1s<σ2s<σ*2s<π2pх=π2pz<σ2py< π*2pх=π*2pz <σ*2py ,
а для элементов конца 2-го периода (O, F, Ne) –
σ1s<σ*1s<σ2s<σ*2s< σ2py <π2pх =π2pz < π*2pх=π*2pz <σ*2py.
Полуразность числа электронов на связывающих (Nсв) и разрыхляющих (Nр) орбиталях носит название порядка(кратности) связи n:
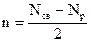 .
.
Молекула образуется, если n>0, т.е. связь может быть образована не только парой, но и одним электроном, и, следовательно, порядок связи может быть не только целым, но и дробным числом. С увеличением порядка возрастает энергия связи.
Двухатомные гомоядерные молекулы элементов 1-го периода. Простейшей молекулой является молекулярный ион 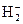 . В соответствии с принципом наименьшей энергии единственный электрон молекулы располагается на σ1s МО. Следовательно, электронная формула молекулярного иона
. В соответствии с принципом наименьшей энергии единственный электрон молекулы располагается на σ1s МО. Следовательно, электронная формула молекулярного иона 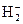 запишется как
запишется как
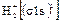 .
.
Электронная формула может быть представлена графически в виде молекулярной (энергетической) диаграммы(рис. 6.12), показывающей относительные энергии атомных и молекулярных диаграмм и число электронов на них.
Порядок связи иона 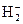 n=(1-0)/2=0,5, следовательно, эта частица может существовать.
n=(1-0)/2=0,5, следовательно, эта частица может существовать.
|



Рис. 6.12. Молекулярная диаграмма 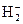
Молекулярный ион 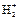 имеет один электрон, поэтому он является парамагнитным, т.е. втягивается в магнитное поле. Все вещества, имеющие неспаренные электроны, относятся к парамагнетикам.
имеет один электрон, поэтому он является парамагнитным, т.е. втягивается в магнитное поле. Все вещества, имеющие неспаренные электроны, относятся к парамагнетикам.
Молекула водорода Н2 содержит два электрона, и ее электронная формула имеет следующий вид:
Н2[(σ1s)2 ].
Из молекулярной диаграммы (рис. 6.13) следует, что порядок связи молекулы водорода равен единице. Увеличение порядка связи от 0,5 до 1 при переходе от 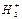 к Н2 сопровождается увеличением энергии связи от 236 до 436 кДж/моль и уменьшением длины связи от 0,106 до 0,074 нм.
к Н2 сопровождается увеличением энергии связи от 236 до 436 кДж/моль и уменьшением длины связи от 0,106 до 0,074 нм.
Электроны молекулы Н2 спарены, и по этой причине молекулярный водород диамагнитен, т.е. выталкивается из магнитного поля. К диамагнетикам относятся все вещества, не содержащие неспаренных электронов.

Рис.6.13. Молекулярная диаграмма Н2
Второй элемент 1-го периода гелий в соответствии с представлениями метода МО может образовывать парамагнитный молекулярный ион 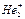 (n=0,5), а молекула Не2 существовать не может, т.к. число электронов на связывающей и разрыхляющей молекулярных орбиталях одинаково и порядок связи равен нулю.
(n=0,5), а молекула Не2 существовать не может, т.к. число электронов на связывающей и разрыхляющей молекулярных орбиталях одинаково и порядок связи равен нулю.
Двухатомные гомоядерные молекулы элементов 2-го периода. Рассмотрим в качестве примера молекулу кислорода. Двенадцать электронов внешних уровней двух атомов кислорода (2s22p4) заполнят молекулярные орбитали следующим образом:
О2 [KK(σ2s)2 (σ*2s)2 (σ2py)2 (π2px)2=( π2pz)2 (π*2px)1 =(π*2px )1].
Cимвол К в электронной формуле означает, что электроны К-уровня (1s2) не участвуют в образовании молекулярных орбиталей. Молекулярная диаграмма молекулы кислорода представлена на рис. 6.14. В соответствии с правилом Гунда два электрона на орбиталях π2px и π2pz являются неспаренными и молекула кислорода является парамагнитной, что подтверждено экспериментально. Отметим, что в рамках метода валентных связей невозможно объяснить парамагнетизм кислорода. Порядок связи в молекуле О2 n=(8-4)/2=2.

Рис. 6.14. Молекулярная диаграмма О2
Порядок связи в двухатомных гомоядерных молекулах элементов 2-го периода увеличивается от 1 у В2 до 3 у N2, а затем уменьшается до 1 у F2. Образование молекул Be2 и Ne2 невозможно, т.к. порядок связи в этих молекулах равен нулю.
Двухатомные гетероядерные молекулы элементов 2-го периода. Атомные орбитали различных атомов вносят различный вклад в молекулярные орбитали, или, что то же самое, коэффициенты сi в уравнениях
ψ+ = с1ψА + с2ψВ;
ψ- = с3ψА – с4ψВ
не равны единице. В связывающую орбиталь больший вклад вносит атомная орбиталь более электроотрицательного элемента, а разрыхляющую – АО более электроположительного элемента. Если атом В более электроотрицателен, чем атом А, то с2>с1, а с3>с4. Связывающие МО по энергии ближе к АО более электроотрицательного атома, а разрыхляющие – к АО более электроположительного атома.
В качестве примера приведем молекулу СО. Десять электронов атомов углерода и кислорода разместятся по МО следующим образом:
СО [KK (σ2s)2 (σ*2s)2 (π2px)2=(π2pz)2(σ2py)2].
Порядок связи в молекуле СО n=(8-2)/2=3. Молекула СО парамагнитна. Молекулярная диаграмма приведена на рис. 6.15.

Рис. 6.15. Молекулярная диаграмма СО
Дата добавления: 2016-10-07; просмотров: 5835;











