Межмолекулярная связь
Рабочая программа. Межмолекулярная связь. Силы Ван-дер-Ваальса: ориентационные, индукционные, дисперсионные. Водородная связь. Влияние на физико-химические свойства веществ.
Между электронейтральными атомами и молекулами в твердом, жидком и газообразном состояниях всегда действуют силы притяжения. Об этом свидетельствуют, например, неидеальность реальных газов, понижение температуры газов при расширении, существование благородных газов в конденсированном состоянии и др.
Различают два типа межмолекулярных взаимодействий:
1) силы Ван-дер-Ваальса;
2) водородная связь.
Иногда к межмолекулярным взаимодействиям относят донорно-акцепторную и металлическую связь.
Силы Ван-дер-Ваальса. Основными свойствами сил Ван-дер-Ваальса являются невысокая энергия (до ~40 кДж/моль) и ненасыщаемость. Различают три типа сил Ван-дер-Ваальса: ориентационные, индукционные и дисперсионные.
Ориентационное (диполь-дипольное) взаимодействиеимеет место только между полярными молекулами. При достаточно малых расстояниях между молекулами противоположно заряженные концы диполей притягиваются, а одноименно заряженные – отталкиваются (рис. 6.17,а) Чем больше дипольные моменты молекул, тем сильнее ориентационное взаимодействие. Ориентационное взаимодействие ослабляется при увеличении температуры и расстояния между молекулами.
Индукционное взаимодействиеосуществляется между молекулами разной полярности. Под действием электрического поля более полярной молекулы неполярная или малополярная молекула поляризуется, т.е. в ней возникает (индуцируется) диполь или увеличивается дипольный момент (рис. 6.17,б). Энергия индукционного взаимодействия определяется величиной дипольного момента полярной молекулы, расстоянием между молекулами и поляризуемостью неполярной молекулы, т.е. ее способностью к образованию диполя под действием внешнего поля.
Дисперсионное взаимодействие является наиболее универсальным, т.е. действует между любыми молекулами независимо от их полярности. Ядро атома и электрон образуют мгновенные диполи, индуцирующие мгновенные диполи у соседних частиц (рис. 6.17,в). Синхронное движение мгновенных диполей разных молекул ведет к понижению энергии системы и притяжению частиц. Энергия дисперсионного взаимодействия увеличивается с ростом поляризуемости частиц, уменьшением расстояния между ними и не зависит от температуры.

Рис. 6.17. Вандерваальсовы взаимодействия: а – ориентационное; б – индукционное; в – дисперсионное
Энергия вандерваальсовых взаимодействий обратно пропорциональна шестой степени расстояния между центрами взаимодействующих частиц. При сильном сближении молекул начинают действовать силы отталкивания между электронными оболочками, которые уравновешивают силы притяжения.
Относительные величины различных типов вандерваальсова взаимодействия для некоторых веществ приведены в табл. 6.1.
Таблица 6.1. Вклад отдельных составляющих в энергию вандерваальсова взаимодействия
| Вещество | Дипольный момент D | Поляризуемость, м3.1030 | Энергия взаимодействия, кДж/моль | ||
| Еор | Еинд | Едисп | |||
| Н2 Хе HI NН3 | 0,38 1,52 | 0,8 4,16 5,42 2,23 | 0,6 13,3 | 0,3 1,5 | 0,17 18,4 60,6 14,7 |
Из табл. 6.1 следует, что увеличение дипольного момента ведет к росту ориентационного и индукционного взаимодействий, а увеличение поляризуемости сопровождается усилением дисперсионного взаимодействия.
Водородная связьявляется особым типом межмолекулярного взаимодействия, который имеет место между молекулами соединений, содержащих группировки F-H, O-H, N-H, т.е. атом водорода и элемент с очень высокой электроотрицательностью.
Электронная плотность связи Э-Н смещена в сторону электроотрицательного элемента. Атом водорода теряет электронную оболочку и превращается в протон. Благодаря своим малым размерам и отсутствию отталкивания электронных оболочек, протон способен вступать в электростатическое взаимодействие с электронной оболочкой сильно электроотрицательного атома соседней молекулы. Одновременно водород выступает в роли акцептора электронной пары, предоставляемой электроотрицательным атомом соседней молекулы.
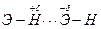 .
.
Силы Ван-дер-Ваальса и отталкивания также вносят вклад в образование водородной связи.
В отличие от сил Ван-дер-Ваальса водородная связь обладает свойствами направленности и насыщаемости.
Энергия водородной связи невелика, составляет от 8 до 40 кДж/моль и возрастает в ряду N-H < O-H < F-H. Тем не менее наличие водородной связи оказывает сильное влияние на физико-химические свойства веществ. Так, молекула воды может участвовать в образовании четырех водородных связей. Это ведет к образованию прочных ассоциатов (Н2О)n, что объясняет высокую температуру плавления и кипения воды по сравнению с ее аналогом – H2S (tкип=-61,8 оС), высокую теплоёмкость (4,218 кДж/кг•К при температуре 273К), высокую энтальпию испарения (2250 кДж/кг). Сероводород как соединение с более высокой молекулярной массой должен был бы иметь более высокую температуру кипения, чем вода. Отсутствие сильных водородных связей у H2S приводит к обратной зависимости.
Водородная связь объясняет образование ассоциатов фторида водорода (HF)n, димеризацию карбоновых кислот:
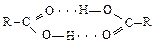
Очень многие химические соединения содержат химические связи N-H и O-H, следовательно, водородные связи встречаются очень часто. Особо важную роль водородные связи играют для биологических объектов. Так, двойные спирали ДНК соединяются межмолекулярными водородными связями.
Вопросы для самостоятельной подготовки
1.Рассмотрите образование ковалентной связи на примере молекулы водорода. Приведите график зависимости потенциальной энергии системы из двух атомов водорода от межъядерного расстояния.
2. Как объяснить большую устойчивость молекулы F2 по сравнению с системой из двух свободных атомов фтора?
3.Приведите электронные структуры атомов элементов 2-го периода в основном и возбужденном состояниях.
4. Почему атом аргона не образует химических связей?
5. Почему атом кислорода образует 2 химические связи, а атом серы – 6?
6. Гибридизация атомных орбиталей. Факторы, благоприятствующие гибридизации. Ориентация гибридных орбиталей в пространстве. sp-, sp2-, sp3- и sp3d2 - гибридизация.
7. Приведите примеры влияния несвязывающих (неподелённых) электронных пар на стереохимию молекул.
8. Как влияет положение элемента в ПСЭМ на устойчивость гибридизации атомных орбиталей? Приведите примеры.
9. Определите тип гибридизации орбиталей центрального атома в ионе гидроксония Н3О+. Изобразите геометрическую форму этой частицы.
10. В чём особенности донорно-акцепторного механизма образования ковалентной связи? Приведите примеры частиц, способных играть роль донора и акцептора электронной пары.
11. Какие факторы влияют на энергию химической связи?
12. Расположите следующие соединения в порядке возрастания длины связи: NaH, NaF, NaCl, NaBr.
13. Расположите следующие связи в порядке увеличения их энергии: а) О-О; О=О; б)О-О; S-S; в)Н-F; H-Cl; H-Br; г)Li-H; Be-H; B-H; C-H.
14. Какая из связей прочнее: а) C-F или C-Br; б) C=O или С-О; в) O=O или S=S?
15. В каких из следующих соединений связь центрального атома является насыщенной: а) IF3; IF5; IF7; б)Cl2O; ClO2; Cl2O7?
16. Определите координационное число атома алюминия в соединениях: а) Li[AlH4]; б) Na3[AlF6].
17. Расположите следующие химические связи в порядке увеличения полярности: Na-O; Na-F; Na-N.
18. Какая из молекул HF, HCl, HBr, HI имеет наибольшую длину диполя?
19. Как изменяется полярность связи в ряду HF, HCl, HBr, HI?
20. Какие факторы влияют на величину дипольного момента следующих молекул: а) NH3, б) РН3, в) AsH3? Какая из этих молекул может иметь наибольший дипольный момент?
21. Какой тип связи реализуется в следующих молекулах: HCl, Cl2, RbСl, ClF?
22. Расположите следующие ионы в порядке уменьшения их поляризующей способности: Na+; Mg2+; Al3+.
23. Расположите следующие ионы в порядке увеличения их поляризуемости:F-; Cl-; Br -;I-.
24. В водном растворе какой соли связь О-Н в молекуле воды будет поляризована в большей степени: NaCl; MgCl2; AlCl3? Почему?
25. В чем причина роста силы галогенводородных кислот, наблюдающегося при увеличении порядкового номера атома галогена?
26. В чем причина увеличения силы гидроксидов щелочных и щелочноземельных элементов, наблюдающегося при увеличении заряда ядра атомов металла?
27. Почему серная кислота сильнее сернистой?
28. Почему уксусная кислота СН3СООН намного слабее трифторуксусной кислоты СF3СООН?
29. Определите сколько σ- и π-связей содержит молекула бутадиена CH2CHCHCH2?
Ответ: 9 σ- и 2 π-связи.
30. Определите сколько σ- и π-связей содержит молекула винилацетилена CHCCHCH2?
Ответ: 7 σ- и 3 π-связи.
31. Изложите основные положения метода молекулярных орбиталей.
32. В чём состоит основное отличие метода МО от метода ВС?
33. Составьте электронную формулу и приведите молекулярную диаграмму молекулы азота. Определите порядок связи и укажите магнитные характеристики молекулы.
34. Составьте электронную формулу и приведите молекулярную диаграмму молекулы фтора. Определите порядок связи и укажите магнитные характеристики молекулы.
35. Составьте электронную формулу и приведите молекулярную диаграмму молекулы оксида азота (II). Определите порядок связи и укажите магнитные характеристики молекулы.
36. Объясните с позиций метода молекулярных орбиталей увеличение энергии связи в ряду фтор, кислород, азот.
37. Как изменится энергия химической связи при переходе от F2 к 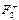 и
и 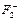 ?
?
38. Какая из перечисленных молекул не должна существовать: а) С2, б) Li2, в) Ве2, г) В2?
39. Какие физические свойства характерны для металлов?
40. Опишите особенности химической связи в металлах и её характеристики.
41. В чём причины различия электропроводностей металлов, полупроводников и изоляторов?
42. Приведите примеры физических явлений, указывающих на наличие взаимодействий между нейтральными атомами и молекулами.
43. Опишите механизм возникновения и характеристики вандерваальсовых взаимодействий.
44. Какие типы вандерваальсовых взаимодействий могут иметь место для следующих веществ: гелия, метана, азота, бромистого водорода?
45. Какой тип сил Ван-дер-Ваальса преобладает в каждом из следующих веществ: O2, H2O, OF2?
46. Опишите взаимодействия, вносящие свой вклад в образование водородной связи.
47. Какой тип связи реализуется при образовании иона Н3О+ из протона и молекулы воды?
48. Для каких из следующих соединений возможны водородные связи: SiH4, HCOOH, CH3CH(NH2)COOH, H2O2, HCl?
49. Почему температура кипения аммиака NH3 выше, чем у фосфина PH3?
50. Почему одноосновная фтористоводородная кислота может образовывать кислые соли, например NaHF2, а соляная кислота аналогичные соединения не образует?
6.6. Задания для текущих и промежуточных контролей
1. Объясните термин «перекрывание атомных орбиталей».
2. Можно ли сказать, что благородные газы He, Ne и другие состоят из молекул?
3. Почему хлорводородная кислота сильнее фторводородной?
4. Что является причиной образования любой химической связи? Каким энергетическим эффектом сопровождается этот процесс?
5. Как изменяется прочность связи в ряду HF, HCl, HBr, HI? Укажите причины этих изменений.
6. Предскажите, какая из связей прочнее: а) С – F или C – Br; б) С = О или С – О; в) О – О или S – S.
7. Расположите следующие связи в порядке увеличения полярности: Na – O, Na – F, Na – N.
8. Расположите указанные связи в порядке возрастания полярности: а) H – F, H – C, H – H; б) P – S, Si – Cl, Al – Cl.
9. Как называется расстояние между центрами ядер атомов в молекуле и каким образом оно влияет на прочность химических связей?
10. Почему и как влияет размер атомов на длину и энергию образующейся между ними связи?
11. Чем объясняется большая устойчивость системы из двух связанных атомов (например, Н2) по сравнению с системой из двух свободных атомов (2Н)?
12. Чем объясняется способность атомов многих элементов к образованию числа связей, превышающих число неспаренных электронов в их атомах в основном состоянии?
13. Укажите факторы, способствующие гибридизации атомных орбиталей.
14. Объясните, каким образом атом углерода, имеющий два неспаренных электрона, может проявлять ковалентность, равную четырем?
15. Сравните механизм образования ковалентных связей в молекулах СН4, NH3 и в ионе 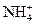 .
.
16. Приведите схему перекрывания атомных орбиталей в молекулах BeCl2 и BF3.
17. Какая из молекул HF, HCl, HBr или HI имеет наибольшую длину диполя?
18. Расположите указанные связи в порядке возрастания полярности:
а) H – F, F – C, F – F;
б) C – N, B – O, Li – l;
в) P – S, Si – Cl, Al – Cl
19. Расположите в порядке возрастания степени ионности связи В – Cl, Na – Cl, Ca – Cl, Be – Cl.
20. Для каких связей длина диполя а) равна нулю; б) меньше длины связей; в) равна длине связей?
21. Укажите донор и акцептор в реакции Н2О + Н+ = Н3О+.
22. Какая из следующих молекул должна иметь наибольший дипольный момент: NH3, PH3, AsH3, BH3?
23. Какая связь называется водородной? Как она влияет на физические свойства веществ?
24. Рассмотрите с позиций метода МО частицу 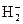 . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
. Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
25. Рассмотрите с позиций метода МО частицу 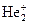 . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
. Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
26. Рассмотрите с позиций метода МО частицу 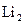 . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
. Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
27. Рассмотрите с позиций метода МО частицу 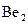 . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
. Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
28. Рассмотрите с позиций метода МО частицу 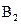 . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
. Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
29. Рассмотрите с позиций метода МО молекулу 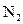 . Каков порядок связи и магнитные свойства этой молекулы?
. Каков порядок связи и магнитные свойства этой молекулы?
30. Рассмотрите с позиций метода МО молекулу 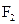 . Каков порядок связи и магнитные свойства этой молекулы?
. Каков порядок связи и магнитные свойства этой молекулы?
Дата добавления: 2016-10-07; просмотров: 7835;











