Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени.
Различают среднюю скорость
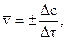 (4.1)
(4.1)
где Δс=с2-с1 – изменение концентрации вещества за промежуток времени Δτ=τ2-τ1. Знак (+) означает, что вещество образуется, а знак ( – ) – что вещество расходуется в ходе реакции.
Истинная (мгновенная) скорость реакции определяется соотношением
 (4.2)
(4.2)
где dc – бесконечно малое изменение концентрации вещества за бесконечно малый промежуток времени dτ.
Основными факторами, определяющими скорость реакции, являются природа реагирующих веществ, концентрация, температура и катализатор. Скорость реакций с участием газообразных реагентов зависит также от давления.
Зависимость скорости реакции от концентрации. Все химические реакции можно разделить на гомогенные и гетерогенные. К гомогенным реакциям относятся реакции, протекающие между веществами, находящимися в одном агрегатном состоянии, если между ними отсутствуют поверхности раздела. К гомогенным реакциям относятся реакции между газами, неограниченно смешивающимися жидкостями и жидкими растворами. Гомогенные реакции протекают в объеме, т.е. имеются наиболее благоприятные условия для контакта молекул реагирующих веществ.
Реакции между веществами, находящимися в разных агрегатных состояниях или в одном агрегатном состоянии, но разделенными поверхностями раздела, относятся к гетерогенным реакциям. К ним относятся, например, реакции между газом и жидкостью, двумя несмешивающимися жидкостями, механическими смесями твердых веществ. В гетерогенных реакциях химический процесс протекает только на поверхностях раздела реагирующих фаз.
Зависимость скорости гомогенной реакции от концентрации определяется законом действующих масс (закон Гульдберга и Вааге, закон действия масс): скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
Для обратимой гомогенной химической реакции, записанной в общем виде,
 (4.3)
(4.3)
скорость прямой реакции
 , (4.4)
, (4.4)
скорость обратной реакции
 , (4.5)
, (4.5)
Где  – концентрации реагирующих веществ, моль/л; a, b, d, e – стехиометрические коэффициенты, или порядок реакции по реагенту A, B, D или E; k1 и k2 – константы скоростей химических реакций.
– концентрации реагирующих веществ, моль/л; a, b, d, e – стехиометрические коэффициенты, или порядок реакции по реагенту A, B, D или E; k1 и k2 – константы скоростей химических реакций.
Константа скорости химической реакции k зависит от температуры и природы реагирующих веществ, но не зависит от их концентрации. Если концентрации реагирующих веществ равны единице, то константа скорости численно равна скорости химической реакции.
Уравнения (4.4) и (4.5) называются кинетическими уравнениями химических реакций.
Скорость гетерогенных реакций не зависит от объемной концентрации реагирующих веществ, т.к. реакция протекает только на поверхности раздела фаз. Чем выше степень измельчения веществ, тем больше их поверхность и тем выше скорость протекания реакций. Скорость гетерогенных реакций зависит также от скорости подвода реагирующих веществ к поверхности раздела фаз и от скорости отвода продуктов реакции. Поэтому перемешивание реакционной смеси ускоряет протекание гетерогенной реакции.
Концентрации газообразных веществ могут быть выражены через парциальные давления. Парциальное давление газа в смеси равно тому давлению, которое производил бы газ, если бы он занимал объем всей смеси при тех же условиях. Парциальное давление i-го компонента газовой смеси (  ) может быть рассчитано по формуле
) может быть рассчитано по формуле
 , (4.6)
, (4.6)
где 
 – общее давление смеси; xi – объемная или молярная доля i-го компонента в смеси.
– общее давление смеси; xi – объемная или молярная доля i-го компонента в смеси.
Общее давление смеси газов равно сумме парциальных давлений компонентов:
 . (4.7)
. (4.7)
Для прямой реакции (4.3), если вещества А и В находятся в газообразном состоянии, выражение для скорости реакции запишется следующим образом:
 , (4.8)
, (4.8)
где  – парциальные давления веществ А и В.
– парциальные давления веществ А и В.
При изменении общего давления в n раз во столько же раз изменяется и парциальное давление каждого компонента и соответственно изменяется скорость реакции.
Пример 4.1.Написать выражения закона действующих масс для реакций:
а) 2NO(г) + Cl2(г) ® 2NOCl(г);
б) СаСО3(к) ® СаО(к) + СО2(г).
Решение. а) для прямой реакции  и для обратной –
и для обратной –  ;
;
б) прямая реакция: карбонат кальция – твердое вещество, присутствие которого не влияет на скорость реакции, искомое выражение будет иметь вид  , т.е. в данном случае скорость реакции при определенной температуре постоянна; обратная реакция:
, т.е. в данном случае скорость реакции при определенной температуре постоянна; обратная реакция:  .
.
Пример 4.2.Во сколько раз следует увеличить концентрацию оксида углерода (II) в системе СО(г) + Н2О(г) ↔ СО2(г) + +Н2(г), чтобы скорость прямой реакции увеличилась в 5 раз?
Решение. Запишем выражение для скорости прямой реакции:
 .
.
Пусть начальная концентрация СО –  , а конечная –
, а конечная –  . Запишем отношение скоростей прямой реакции:
. Запишем отношение скоростей прямой реакции:
 , откуда следует, что
, откуда следует, что  , т.е.
, т.е.
для увеличения скорости прямой реакции в 5 раз концентрацию СО следует увеличить также в 5 раз.
Пример 4.3.Определить, как изменится скорость прямой реакции 2SO2 + O2 ↔ 2SO3, если общее давление в системе увеличить в 4 раза.
Решение. Увеличение давления в системе в 4 раза вызовет уменьшение объема системы в 4 раза, а концентрации реагирующих веществ возрастут в 4 раза.
Согласно закону действующих масс начальная скорость прямой реакции
 .
.
После увеличения давления
 .
.
После увеличения давления в 4 раза скорость реакции возросла в 64 раза.
Порядок реакции. Сумма показателей степеней при концентрациях или парциальных давлениях в кинетических уравнениях реакций называется порядком реакции. Для прямой реакции

порядок равен а+b, а для обратной – d+e. Эта величина характеризует тип зависимости скорости реакции от концентрации. Порядок реакции обычно нельзя определить теоретически по виду химического уравнения. Это связано с тем, что подавляющее большинство реакций являются сложными, т.е. они протекают через некоторое число промежуточных стадий (истинный механизм реакции), которые чаще всего неизвестны. Порядок каждой из промежуточных стадий может отличаться от порядка реакции, определяемого из уравнения (формальный порядок реакции), т.к. в уравнении приводятся обычно только исходные вещества и конечные продукты реакции (суммарный или глобальный механизм).
По этой причине истинный порядок химической реакции и порядок реакции по каждому реагенту определяют экспериментально. Истинный порядок реакции в отличие от формального может быть как целым, так и дробным и даже нулевым. Реакции с порядком выше трех неизвестны.
Молекулярность реакции. Число молекул или иных формульных единиц, участвующих в элементарном акте химического превращения, называется молекулярностью реакции.
Формальная молекулярность реакции, определяемая по уравнению химической реакции как сумма стехиометрических коэффициентов, обычно отличается от истинной молекулярности, находимой экспериментально. Причины те же, что и в случае различия истинного и формального порядка реакций.
Приведем несколько примеров простых реакций, чьи механизмы совпадают с уравнениями реакций.
1) Мономолекулярные реакции. К ним обычно относятся реакции диссоциации и изомеризации:
О3 → О2 + О

циклопропан пропен
2) Димолекулярные реакции:
I2 + H2 ↔ 2HI.
3) Тримолекулярные реакции:
2NO + O2 = 2NO2;
2NO + Br2 = 2NOBr.
Большинство элементарных реакций относятся к моно- и димолекулярным взаимодействиям. Тримолекулярные реакции встречаются редко. Реакции с более высокой молекулярностью неизвестны, т.к. вероятность одновременного столкновения четырех и более частиц, сопровождающегося химическим превращением, чрезвычайно мала.
Зависимость скорости реакции от температуры. Для большинства реакций справедливо правило Вант-Гоффа: повышение температуры на 10К увеличивает скорость большинства реакций в 2–4 раза:
 ,(4.9)
,(4.9)
где  и
и  – скорости реакции при Т1 и Т2; γ – термический коэффициент скорости химической реакции,
– скорости реакции при Т1 и Т2; γ – термический коэффициент скорости химической реакции,  .
.
Увеличение скорости реакции вызвано ростом константы скорости реакции, поэтому формула (4.9.) может быть записана также в виде
 ,(4.10)
,(4.10)
где  и
и  – константы скорости реакции при Т1 и Т2.
– константы скорости реакции при Т1 и Т2.
Пример 4.4. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 75°С?
Решение. Подставим данные в выражение правила Вант-Гоффа (3.9):
 ,
,
или  .
.
Следовательно, скорость реакции увеличилась в 287 раз.
Пример 4.5.При температуре 80 °С реакция заканчивается за 20 с. Сколько времени будет длиться реакция при температуре 20 °С, если температурный коэффициент этой реакции равен 2,5?
Решение. Скорость химической реакции обратно пропорциональна времени ее протекания, следовательно,
 ,
,
где τ1 и τ2 – время протекания реакции при температурах Т1 и Т2.
Правило Вант-Гоффа в данном случае можно записать как
 .
.
Отсюда  .
.
Логарифмируем: lg t1 = lg 20 + 6lg 2,5 = 1,3010 + 6×0,3979 = =3,6884;
t1 = 4879 c = 1 ч 21 мин 19 с.
При температуре 20 °С реакция заканчивается за 1 ч 21 мин 19 с.
Элементарный акт химического превращения является результатом столкновения молекул реагирующих веществ. Молекулы газов и жидкостей испытывают ежесекундно огромное число столкновений (~1010 столкновений/с в случае газов). Однако только очень малая доля столкновений заканчивается химическими превращениями. Такие столкновения называются эффективными соударениями. Молекулы, участвующие в эффективных соударениях, называют активными молекулами. От прочих молекул они отличаются значительно большей энергией. Избыточная энергия необходима молекулам для преодоления сил отталкивания внешних электронных оболочек и для образования активированного комплекса, т.е. промежуточного соединения между исходными веществами и конечными продуктами. В активированном комплексе старые связи еще не полностью разрушены, а новые еще не полностью образовались. Образование активированного комплекса в реакции взаимодействия водорода и йода можно представить следующей схемой:

исходные активированный конечные
вещества комплекс продукты
При повышении температуры быстро увеличивается доля молекул с высокой энергией, достаточной для образования активированного комплекса (рис. 4.1).
Изменение энергии в ходе химической реакции можно показать с помощью схемы процесса активации (рис. 4.2). По оси ординат отложена потенциальная энергия системы. Абсцисса носит название координаты реакцииили реакционного пути. В процессе химического превращения переход системы из начального состояния с энергией ΣНi в конечное состояние с ΣНf происходит через энергетический барьер  .
.

 Энергия активации (Е*)–это энергия, необходимая для перевода в состояние активированного комплекса 1 моль реагирующих веществ.Разность ΣНf - ΣНi составляет тепловой эффект реакции (ΔrH). Для обратной реакции тепловой эффект будет иметь ту же величину, но противоположный знак. Для обратной реакции энергия активации составит величину
Энергия активации (Е*)–это энергия, необходимая для перевода в состояние активированного комплекса 1 моль реагирующих веществ.Разность ΣНf - ΣНi составляет тепловой эффект реакции (ΔrH). Для обратной реакции тепловой эффект будет иметь ту же величину, но противоположный знак. Для обратной реакции энергия активации составит величину  .
.


Из рис. 4.2 видно, что для перевода веществ в состояние активированного комплекса энергия всегда должна быть затрачена, независимо от знака теплового эффекта реакции.
Скорость реакции сильно зависит от величины энергии активации, которая в большинстве случаев находится между 20 и 280 кДж/моль. Реакции с энергиями активации до 40 кДж/моль протекают с высокими скоростями уже при обычных температурах, тогда как скорости реакций с энергиями активации больше 120 кДж/моль малы даже при повышенных температурах.
Уравнение Аррениуса. Зависимость константы скорости химической реакции от температуры описывается уравнением Аррениуса:
 , (4.11)
, (4.11)
где k – константа скорости реакции; ko – константа, зависящая от природы реагирующих веществ (предэкспоненциальный множитель); е – основание натуральных логарифмов; Е* – энергия активации; R – универсальная газовая постоянная; Т – температура, К.
Из уравнения (4.11) следует, что константа скорости, а следовательно, и скорость химической реакции экспоненциально растут с увеличением температуры.
Константа скорости химической реакции зависит также от энтропии активации. Для того чтобы соударение активных молекул закончилось химическим превращением, они должны быть ориентированы так, чтобы в соприкосновение пришли реакционноспособные группы. В ином случае превращение не произойдет. Например, реакция этерификации бензойной кислоты

произойдет только при столкновении реагирующей частицы с группировкой _СООН. При иных ориентациях реакция этерификации невозможна. Отношение числа благоприятных для реакции ориентаций к общему числу возможных ориентаций определяет величину энтропии активации. Чем сложнее молекулы реагирующих веществ, тем меньше энтропия активации и меньше скорость химической реакции.
Катализ.Скорость химических реакций сильно зависит от присутствия катализаторов. Например, реакция
2Н2О2 = 2Н2О + О2
идет очень медленно при комнатной температуре. При добавлении к пероксиду водорода небольшого количества оксида марганца (IV) MnO2 реакция протекает бурно. Оксид мар- ганца (IV) является катализатором реакции разложения перексида водорода.
Катализаторами называют вещества, ускоряющие химические реакции и остающиеся после реакций химически неизменными.Физическое состояние катализатора может изменяться.
Существуют вещества, замедляющие скорость химических реакций, – ингибиторы.
Катализаторы разнообразных химических реакций в живых организмах носят название ферментов.
Многие катализаторы обладают селективностью, или избирательностью, т.е. способностью ускорять только одну из возможных реакций или только реакции одного класса. Например, этанол в присутствии оксида алюминия подвергается реакции дегидратации:
 ,
,
а в присутствии меди протекает реакция дегидрирования:
 .
.
Активность катализаторов может быть повышена добавлением небольшого количества веществ, не обладающих каталитической активностью и называемых промоторамиили каталитическими активаторами.Например, оксид алюминия Al2O3 не является катализатором синтеза аммиака, но добавление нескольких процентов Al2O3 к катализатору этой реакции – железу – увеличивает его активность в 20 раз. Следовательно, Al2O3 – промотор.
С другой стороны, активность катализатора резко уменьшается в присутствии веществ, называемых каталитическими ядами. Они также обладают селективным действием. Так железо – катализатор синтеза аммиака – может быть отравлено кислородом, водой, оксидом углерода (II) CO, сульфидом водорода Н2S и др.
Если катализатор и реагирующие вещества находятся в одном агрегатном состоянии, обычно газообразном, жидком или растворённом, то катализ называется гомогенным. В роли катализаторов в гомогенном катализе часто выступают растворы кислот, оснований, солей d-элементов, растворители.
Катализ является гетерогенным, если катализатор и реагирующие вещества находятся в разных агрегатных состояниях или образуют самостоятельные фазы. В роли катализаторов в этом случае чаще всего выступают твердые вещества, обычно d-элементы или их соединения.
Следует отметить, что катализаторы не изменяют энтальпию и энергию Гиббса реакции и не влияют на положение химического равновесия реакции. Катализаторы только увеличивают в равной мере скорость прямой и обратной реакций.
Гомогенный катализ. Механизм действия катализаторов основан на теории промежуточных соединений(Н.Д. Зелинский, П. Сабатье). Согласно этой теории катализатор образует с реагирующими веществами промежуточные соединения. Энергия активации этого процесса меньше, чем энергия активации некаталитической реакции, что и ведет к увеличению скорости превращения.
Пусть имеются две реакции, протекающие с невысокой скоростью:
A + B = AB; CD = C + D.
В присутствии катализатора К реакции протекают в две стадии:
А + К = АК; CD + K = CDK,
где АК и CDK являются промежуточными соединениями (интермедиатами), образующими конечные продукты:
АК + В = АВ + К; CDK = C + D + K.
Скорость реакции увеличится, если энергия активации реакций образования и распада промежуточных соединений будет меньше энергии активации некаталитической реакции. В противоположном случае скорость реакции уменьшится и вещество К будет выполнять роль ингибитора. Из схем превращения следует, что после реакции катализатор остается химически неизменным.
Энергетическая схема реакции A + B = AB приведена на рис. 4.3. Из рисунка следует: 1) энергии из промежуточных стадий  меньше энергии активации некаталитической реакции Е*; 2) использование катализатора не изменяет энтальпию реакции ΔrH.
меньше энергии активации некаталитической реакции Е*; 2) использование катализатора не изменяет энтальпию реакции ΔrH.
Примером гомогенного катализа может быть получение серной кислоты башенным способом. Некаталитическая реакция протекает по уравнению
2H2SO3 + O2 = 2H2SO4.
Катализатором является газообразный оксид азота (II) (NO), в присутствии которого реакция идет по следующей схеме:
2NO + O2 = 2NO2;
NO2 + H2SO3 = H2SO4 + NO.
В этом процессе NO2 является промежуточным соединением.

|


Гомогенными каталитическими реакциями являются ферментативные процессы, протекающие в живых организмах.
Недостатком гомогенных промышленных каталитических процессов является необходимость разделения продуктов реакции и катализатора. По этой причине в промышленности чаще используют гетерогенный катализ.
Гетерогенный катализ. Наиболее распространен гетерогенный катализ с использованием твердых катализаторов и жидких или газообразных реагентов. Механизм действия твердых катализаторов очень сложен и до конца не известен. Существует несколько теорий гетерогенного катализа.
Исходной стадией гетерогенного катализа является адсорбция реагентов, т.е. связывание молекул реагирующих веществ с поверхностью другого вещества, в данном случае с поверхностью катализатора. Продукт взаимодействия катализатора с реагирующими веществами может рассматриваться как промежуточное соединение. Процесс адсорбции происходит в несколько стадий. Благодаря диффузии молекулы реагирующих веществ подходят к поверхности, где происходит их адсорбция вследствие высокой реакционной способности атомов или ионов, находящихся в поверхностном слое катализатора. Это объясняется ненасыщенностью связей атомов, находящихся на поверхности, электростатическим взаимодействием на геометрических дефектах поверхности и другими причинами. Взаимодействие адсорбированных частиц реагентов с поверхностью катализатора ведет к увеличению их энергии. По этой причине процесс называется активированной адсорбцией.Активированная адсорбция протекает не на всей поверхности катализатора, а только на так называемых активных центрах, роль которых выполняют различные дефекты поверхности. Число активных центров определяет активность катализатора и зависит от способа приготовления катализатора и площади его поверхности. По этой причине катализаторы обычно наносят на пористые носители с сильно развитой поверхностью. Отравление катализаторов каталитическими ядами объясняется связыванием этими соединениями активных центров.
В результате активированной адсорбции изменяется электронная структура молекул реагентов, что ведет к снижению энергии активации, и на поверхности катализатора протекает химическая реакция.
Продукт химической реакции покидает поверхность катализатора, т.е. происходит десорбция, и за счет диффузии переходит в окружающую среду.
Все три стадии гетерогенного каталитического процесса – адсорбция, образование активированного комплекса и десорбция – являются активационными процессами и характеризуются собственными энергиями активации. Скорость каталитической реакции возрастает, если энергия активации каждой из этих стадий будет ниже энергии активации соответствующей некаталитической реакции (рис. 4.4).



Примером гетерогенного катализа может быть процесс получения серной кислоты контактным способом с использованием в качестве катализатора окисления SO2 кислородом V2O5 – оксид ванадия (V). Реакция протекает по следующим стадиям:
V2O5. nSO3 + SO2 → V2O4. (n+1)SO;
желтый зелено-голубой
V2O4. (n+1)SO3+ 1/2O2 → V2O5. (n+1)SO3;
V2O5. (n+1)SO3 → V2O5. nSO3 + SO3,
или суммарно SO2 + 1/2O2 → SO3.
Промежуточными соединениями в данной реакции яв-
ляются V2O4. (n+1)SO3 и V2O5. (n+1)SO3.
Вопросы и задачи для самостоятельной подготовки
1. Дайте определения средней и истинной скоростей химической реакции.
2. Какой смысл имеют положительный и отрицательный знак скорости химической реакции?
3. Сформулируйте закон действующих масс и запишите его выражение для гомогенной реакции 2А +3В.
4. Напишите выражения закона действующих масс (кинетические уравнения) с использованием молярных концентраций и парциальных давлений для прямой реакции:
а) N2Н4(г) + О2(г) = N2(г) +2Н2O(г);
б) Fe3O4(т) + СО(г) =3FeО(т) + СО2(г);
в) 6НF(г)+N2(г)=2NF3(г)+3Н2(г);
г) СuO(т)+С(Т)=Сu(т)+СО(г).
5. Приведите по 2 примера гомогенных и гетерогенных химических реакций. Запишите для них выражения для скорости химической реакции.
6. От каких факторов зависит численное значение константы скорости химической реакции?
7. Как изменится скорость прямой реакции SO2(г)+2H2S (г)=3S(т)+2Н2O(г), если: а) увеличить концентрацию оксида серы (IV) в 4 раза; б) уменьшить концентрацию сероводорода в 2 раза?
Ответ: а) скорость реакции увеличится в 4 раза; б) скорость реакции уменьшится в 4 раза.
8.Во сколько раз скорость обратной реакции станет больше скорости прямой реакции в реакции 4NН3(г)+3O2(г)↔2N2(г)+6Н2О(г), если увеличить давление в 2 раза?
Ответ: в 2 раза.
9. Сформулируйте понятия порядка и молекулярности реакции.
10. Каким образом по уравнению химической реакции можно сделать вывод о различиях истинного и формального порядка и молекулярности.
11. Определите формальный порядок и молекулярность прямой и обратной реакции в примере 4в. Протекают эти реакции в одну или в несколько стадий?
12. Сформулируйте закон Вант-Гоффа.
13. Сформулируйте определение термического коэффициента скорости химической реакции.
14. Известны химические реакции, протекающие в жидкокристаллических растворителях, с термическим коэффициентом γ<1. Как изменяется скорость этих реакций с увеличением температуры?
15. Температурный коэффициент скорости реакции равен 2. Во сколько раз изменится скорость реакции, если повысить температуру от 20 до 80°С?
Ответ: увеличится в 64 раза.
16. При какой температуре реакция закончится за 1 мин, если при температуре 0°С она проходит за 60 мин.? Температурный коэффициент скорости реакции равен 3.
Ответ: 37,3°С.
17. Две реакции при температуре 60°С протекают с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, а второй – 3. Как будут относиться скорости реакций, если первую проводить при температуре 100 °С, а вторую – при температуре 40 °С?
Ответ: скорость первой реакции возрастет в 16 раз, а второй – уменьшится в 9 раз. Отношение скоростей составит v1/v2 = 144.
18. Дайте определение энергии активации химической реакции.
19. Изобразите энергетическую схему хода эндотермической реакции.
20. Каким образом величина теплового эффекта химической реакции влияет на энергию активации? Ответ аргументируйте.
21. Для двух реакций, протекающих при одинаковых температурах k1>k2. Как соотносятся между собой величины  , и
, и  ?
?
22. Дайте определение явления катализа.
23. Каким образом можно повлиять на активность катализатора?
24. Изобразите энергетическую схему гомогенной каталитической реакции. Опишите основные стадии процесса.
25. Изобразите энергетическую схему гетерогенной каталитической реакции. Опишите основные стадии процесса.
26. Укажите основные области применения катализа. Приведите примеры каталитических процессов.
Дата добавления: 2016-10-07; просмотров: 7271;

 – энергии активации стадий каталитической реакции
– энергии активации стадий каталитической реакции










