Химическое равновесие
Рабочая программа. Химическое равновесие. Константа химического равновесия, Кс, Кр. Константа химического равновесия и изменение энергии Гиббса химической реакции. Смещение химического равновесия. Принцип Лё Шателье. Способы смещения химических равновесий.
Рассмотрим обратимую химическую реакцию между йодом и водородом:
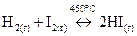 .
.
Скорости прямой и обратной реакций определяются соотношениями
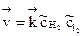 ;
;
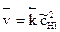 ,
,
где 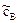 – текущая (неравновесная) концентрация реагента.
– текущая (неравновесная) концентрация реагента.
В начальный момент времени скорость прямой реакции определяется начальной концентрацией йода и водорода, а скорость обратной реакции равна нулю, т.к. начальная концентрация йодида водорода также равна нулю. По мере расходования йода и водорода и образования йодида водорода скорость прямой реакции уменьшается, а скорость обратной реакции растет. Изменение концентраций реагентов в ходе реакции показано на рис. 4.7.

Из рис. 4.7 следует, что, начиная с некоторого момента, состав реакционной смеси перестает изменяться. Это отвечает равенству скоростей прямой и обратной реакций:
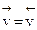 , или
, или 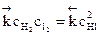 , или
, или 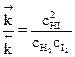 ,
,
где сВ – равновесная концентрация реагента.
Такое состояние реагирующей системы называется химическим равновесием. Состояние химического равновесия устойчиво и может сохраняться неограниченно долго при постоянных внешних условиях. Это не означает прекращения реакций. В состоянии химического равновесия прямая и обратная реакции протекают с равными скоростями, следовательно, химическое равновесие является динамическим равновесием.
Отношение констант скоростей прямой и обратной реак-
ций является также величиной постоянной и носит название константы химического равновесия:
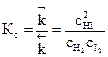 .
.
Величина константы химического равновесия зависит только от природы реагирующих веществ и температуры. Катализатор не влияет на величину константы химического равновесия. Он лишь ускоряет достижение состояния химического равновесия.
Для обратимой реакции, записанной в общем виде
аА + bB ↔ dD + eE,
константа химического равновесия, выраженная через молярные концентрации, запишется следующим образом:
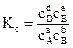 . (4.12)
. (4.12)
Концентрации реагирующих веществ могут быть выражены различными способами, например через парциальные давления. В этом случае константа равновесия реакции в общем виде будет выглядеть так:
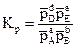 . (4.13)
. (4.13)
Отметим, что константа равновесия гетерогенных реакций не включает концентрации твердых веществ. Например, константа равновесия реакции термического разложения карбоната кальция
СаСО3(т ) = СаО(т) + СО2(г)
запишется как
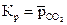 .
.
Пример 4.6.В системе А(г) + 2В(г) ↔ С(г) равновесие установилось при следующих концентрациях веществ: сА = =0,06 моль/л; сВ=0,12 моль/л; сС = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение. Константа равновесия данной реакции выражается уравнением
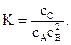
Подставляя в него данные задачи, получим
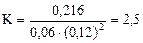 .
.
Для нахождения исходных концентраций веществ А и В учтем, что согласно уравнению реакции из 1 моль А и 2 моль В образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моль вещества С, то при этом было израсходовано 0,216 моль А и 0,432 моль В (0,216×2 = =0,432).Таким образом, исходные концентрации А и В равны:
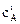 = 0,06 + 0,216 = 0,276 моль/л;
= 0,06 + 0,216 = 0,276 моль/л; 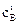 = 0,12 + 0,432 =0,552 моль/л.
= 0,12 + 0,432 =0,552 моль/л.
Пример 4.7.При некоторой температуре константа диссоциации йодида водорода на простые вещества равна 6,25×10-2. Какой процент HI диссоциирует при этой температуре?
Решение. Уравнение реакции диссоциации HI имеет вид
2HI ↔ H2 + I2.
Обозначим начальную концентрацию HI через 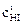 (моль/л). Если к моменту наступления равновесия из каждых
(моль/л). Если к моменту наступления равновесия из каждых 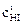 моль HI продиссоциировало xмоль, то при этом согласно уравнению реакции образовалось 0,5xмоль Н2 и 0,5xмоль I2.
моль HI продиссоциировало xмоль, то при этом согласно уравнению реакции образовалось 0,5xмоль Н2 и 0,5xмоль I2.
Таким образом, равновесные (конечные) концентрации составляют
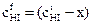 моль/л и
моль/л и 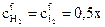 моль/л.
моль/л.
Подставим эти значения в выражение константы равновесия реакции:
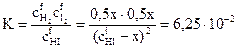 .
.
Решая уравнение, получим x = 0,333С.
Значит, к моменту наступления равновесия продиссоциировало 33,3 % исходного количества иодида водорода.
Константа химического равновесия связана с изменением энергии Гиббса химической реакции простым соотношением
ΔrGo = -RTlnK=-19,14ТlgK. (4.14)
Из (4.14) следует, что, если
ΔrGo <0 , то K>1;
ΔrGo = 0, то K=1;
ΔrGo >0, то K<1.
Константа химического равновесия может быть рассчитана по величине изменения энергии Гиббса реакции:
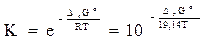 . (4.15)
. (4.15)
Смещение химического равновесия. Принцип Лё Шателье. Состояние химического равновесия сохраняется неограниченно долго при неизменных внешних условиях. Любое изменение условий химического равновесия (Т, р, с) приводит к изменению положения равновесия, т.е. установлению нового равновесия. Направление смещения равновесия определяется принципом Лё Шателье: любое изменение одного из условий химического равновесия (температуры, давления, концентрации) приводит к смещению равновесия в направлении реакции, протекание которой уменьшает эффект произведенного изменения.
1) Влияние температуры. Повышение температуры смещает положение равновесия в сторону эндотермической реакции, а понижение – в сторону экзотермического процесса.
2) Влияние давления. Давление влияет на положение равновесия реакций, протекающих с участием газообразных веществ. Увеличение давления смещает положение равновесия реакции в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления. При уменьшении давления равновесие смещается в сторону увеличения числа молей газообразных веществ, т.е. в сторону увеличения давления.
Изменение объёма реакционной системы также влияет на положение равновесия. Увеличение объёма реакционной системы с участием газов ведёт к снижению давления и смещает равновесие в сторону образования большего числа молей газообразных веществ, т.е. в сторону увеличения давления. Уменьшение объёма ведёт к росту давления и смещает положение равновесия в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления.
3) Влияние концентрации. Увеличение концентрации одного из реагирующих веществ смещает равновесие в сторону реакции, ведущей к его связыванию, и, наоборот, уменьшение концентрации вещества смещает равновесие в сторону процесса образования этого соединения.
Пример 4.8.В каком направлении сместится равновесие реакции
С(тв) + СО2(г) ↔ 2СО(г); ΔrH=119,8 кДж
при а) увеличении температуры; б) увеличении концентрации СО; в) уменьшении давления: г) уменьшении объёма системы?
Решение. а) Прямая реакция является эндотермической, следовательно, увеличение температуры сместит равновесие в сторону прямой реакции, т.е. реакции образования СО.
б) Увеличение концентрации СО сместит положение равновесия в сторону обратной реакции, результатом чего будет уменьшение концентрации СО.
в) Уменьшение общего давления в системе приведет к смещению положения равновесия в сторону прямой реакции, результатом чего будет увеличение давления вследствие образования 2 моль газообразного СО из 1 моль углекислого газа СО2. Наличие твердого углерода на положение равновесия не влияет.
г) Уменьшение объёма системы эквивалентно увеличению давления. Следовательно, положение равновесия сместится в сторону обратной реакции, что прведёт к дополнительному образованию углекислого газа и снижению общего давления.
Вопросы и задачи для самостоятельной подготовки
1. Дайте определение химического равновесия. Особенности химического равновесия.
2. Дайте определение константы химического равновесия. От каких факторов зависит константа равновесия?
3. Приведите примеры гомогенной и гетерогенной обратимых химических реакций. Запишите выражения констант равновесия для этих реакций, используя различные способы выражения состава системы.
4.В гомогенной системе А +2В ↔2С равновесные концентрации веществ равны: сА=сВ=сС=0,2 моль/л. Вычислите константу равновесия и начальные концентрации веществ А и В.
Ответ:Кс = 5; сА=0,3 моль/л; сВ=0,4 моль/л.
5. Вычислите константу равновесия системы H2 + I2 ↔ 2 HI, если начальные концентрации водорода и йода равны 2 и 1,6 моль/л соответственно, а равновесная концентрация HI равна 2,4 моль/л.
Ответ: Кс = 18.
6. Константа скорости прямой реакции А + 2В ↔ 3С равна 0,5 л2/(моль2•с). Начальные концентрации сА= 3 моль/л; сВ = 4 моль/л. В результате реакции равновесная концентрация вещества В оказалась равна 1 моль/л. Найдите равновесную концентрацию вещества А и скорость прямой реакции в момент равновесия.
Ответ: сА = 1,5 моль/л; v = 0,75 моль/(л×с).
7. Константа равновесия реакции А + В ↔ С + D равна
единице. Сколько процентов вещества А подвергнется превращению, если смешать 4 моль вещества А и 6 моль вещества В?
Ответ: 60 %.
8. Найдите константу равновесия и равновесные концентрации всех участников реакции 2SO2(г) + O2(г) ↔2SO3(г) , если начальные концентрации оксида серы(IV) и кислорода составляли 4 и 2,5 моль/л соответственно, а к моменту равновесия прореагировало 25% SO2.
Ответ :Кс=0,055л/моль; 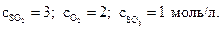
9.Рассчитайте константу скорости реакции при температуре 430 К, если константа скорости реакции при температуре 357 К равна 10-6 л/(моль×с), а энергия активации реакции равна 190,9 кДж/моль.
Ответ: 0,055 л/(моль×с).
10. Сформулируйте принцип Лё Шателье.
11. В каком направлении сместится равновесие реакции
2SO2(г) + O2(г) ↔2SO3(г); ΔrH=-196,6 кДж
при а )увеличении температуры; б) увеличении концентрации SO2; в) уменьшении концентрации SO3; г) уменьшении парциального давления кислорода; д) увеличении общего давления?
Ответ:а)влево; б)вправо; в)вправо; г)влево; д)вправо.
12.Какие факторы способствуют смещению равновесия в системе СаСО3 ↔ СаО + СО2 вправо, если DrH0 > 0?Как повлияет на положение равновесия увеличение количества карбоната кальция?
13. Едкий натр растворяется в воде с выделением теплоты. Как влияет повышение температуры на растворимость гидроксида натрия?
Дата добавления: 2016-10-07; просмотров: 3681;











