Скорость химических реакций
Рабочая программа. Скорость химической реакции. Условия, влияющие на скорость химической реакции.
Зависимость скорости реакции от концентрации. Закон действующих масс (закон Гульдберга и Вааге). Константа скорости химической реакции. Кинетические уравнения гомогенных и гетерогенных химических реакций. Порядок и молекулярность химической реакции.
Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Термический коэффициент скорости химической реакции. Эффективные соударения. Активированный комплекс. Энергетическая схема хода реакции. Уравнение Аррениуса. Энергия активации.
Катализ. Катализаторы и ингибиторы. Селективность катализаторов. Каталитические промоторы и яды. Механизмы гомогенного и гетерогенного катализа.
Изменение энергия Гиббса позволяет установить принципиальную возможность протекания реакции, но не позволяет выяснить скорость ее протекания. Например, для реакции
NO(г) + 1/2О2(г) = NO2(г) 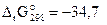 кДж/моль,
кДж/моль,
а для реакции
Н2(г) + 1/2О2(г) = Н2О(г) 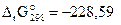 кДж/моль.
кДж/моль.
Обе реакции принципиально осуществимы, но первая из них протекает быстро при комнатной температуре, а вторая при этих условиях без катализатора практически не идет. Следовательно, фактическое осуществление той или иной реакции зависит также от скорости процесса.
Скорости химических реакций и факторы, от которых они зависят, изучаются разделом химии – химической кинетикой.Она изучает также элементарные стадии химических превращений, т.н. механизмы химических реакций.
Дата добавления: 2016-10-07; просмотров: 2405;











