Оксиды и кислоты фосфора.
Химия Бора.
Электронная конфигурация: [He] 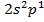
Бор сравнительно мало распространен в природе. К главным природным соединениям бора относятся борная кислота и соли борных кислот (наиб. известна бура 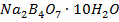 ).
).
Бор расположен в третьей группе периодической системы, но по своим свойствам наиболее сходенне с другими элементами этой группы, а с элементом четвертой группы — кремнием (проявление «диагонального сходства»).
Как и кремний, бор образует соединения с металлами, многие из которых отличаются большой твердостью и высокими температурами плавления.
Свободный бор получают восстановлением борного ангидрида 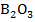 магнием (бор выделяется в виде аморфного порошка, загрязненного примесями).
магнием (бор выделяется в виде аморфного порошка, загрязненного примесями).
Чистый кристаллический бор получают термическим разложением или восстановлением его галогенидов, а также разложением водородных соединений бора. Он имеет черный цвет и среди простых веществ по твердости уступает только алмазу.
Вода не действует на бор; концентрированные же серная и азотная кислоты окисляют его в борную кислоту. Например:
В + 3HN 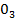 =
= 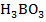 + 3N
+ 3N 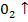
При комнатной температуре бор соединяется только с фтором, на воздухе он не окисляется.
Если нагреть аморфный бор до 700 °С, то он загорается и горит красноватым пламенем, превращаясь в оксид; при этом выделяется большое количество теплоты:
4В(К) + 302(г) = 2В203(к), ∆Н = —2508 кДж.
При высокой температуре бор соединяется со многими металлами, образуя бориды, например, борид магния Mg3B2.
Многие бориды очень тверды и химически устойчивы, причем сохраняют эти свойства при высоких температурах. Для них характерна также тугоплавкость.
С галогенамибор также реагирует при нагревании и образует вещества общей формулы ВГ3. В этих соединениях бор образует с галогенами плоские молекулы с углами между связями Г-В-Г, равными 120°. Такая геометрия молекул ожидается при рассмотрении отталкивания электронных пар валентной оболочки и на основании вр2-гибридизации орбиталей бора.
Галогениды бора, как и другие соединения бора неполимерного строения, являются электронодефицитными. Так, в молекуле трифторида бора при линейной комбинации 2s, 2рх, 2ру, 2рг АО бора и по одной валентной p-АО (с неспаренным электроном) каждого атома фтора образуется 4 + 3 = 7 молекулярных орбиталей. На этих МО попарно располагаются 3 + 3 = 6 электронов. Таким образом, в молекуле трифторида бора незанятыми остаются 7 — 6/2 = 4 МО. Одна из МО, перпендикулярная плоскости молекулы, не участвует в связывании с атомами фтора. Но она обладает достаточно низкой энергией за счет релаксации (сжатия в данном случае, см. рис. 4.35 и 4.36) р-орбитали бора под действием сильно электроотрицательного фтора. Поэтому размещение на данной МО электронной пары другого атома или иона становится энергетически выгодным, а молекула BF3 может, следовательно, быть акцептором электронной пары. Действительно, BF3 соединяется по донорно-акцепторному способу с водой, аммиаком и другими веществами; известен также комплексный анион BF4 • Формально данный процесс можно изобразить схемой:
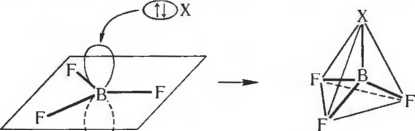
Во всех подобных соединениях ковалентность и координационное число бора равны четырем, а атом бора образует тетраэдрические структуры, определяемые минимумом энергии. Это объясняется отталкиванием 4-х электронных пар валентной оболочки или sp3-гибридизацией атома бора.
Бороводороды (бораны). При действии соляной кислоты на борид магния Mg3B2 получается сложная смесь различных бороводородов. Из этой смеси выделены в чистом виде следующие бороводороды:

Главным продуктом взаимодействия борида магния с соляной кислотой является тетраборан В4Н10 — летучая жидкость (темп. кип. 18 °С), пары которой воспламеняются на воздухе. При хранении тетрабо- ран постепенно разлагается с образованием простейшего из полученных бороводородов — диборана В>Н6. Последний представляет собой газ, конденсирующийся в жидкость при —92,5 °С. На воздухе он не загорается, но водой, как и другие бороводороды, тотчас же разлагается с отщеплением водорода и образованием борной кислоты Н3ВО3:
В2Н6 + 6Н20 — 2Н3ВО3 + 6Н2.
Атомы бора в молекулах бороводородов связаны друг с другом водородными «мостиками», например:
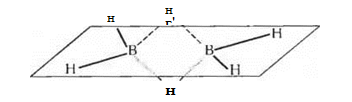
Штриховой линией и пунктиром на этой схеме показаны трехцентровые связи: здесь общая пара электронов занимает молекулярную орбиталь, охватывающую три атома — «мостиковый» атом водорода и оба атома бора. Такая орбиталь образуется вследствие перекрывания ls-орбитали атома водорода с sp3-гибридными орбиталями двух атомов бора. Четыре «концевых» атома водорода связаны с атомами бора обычными двухцентровыми двухэлектронными связями. Таким образом, из двенадцати валентных электронов имеющихся в атомах, составляющих молекулу диборана, восемь участвуют в образовании двухцентровых связей В -Н, а четыре образуют две трехцентровые связи В-Н-В.
Оксид бора, или борный ангидрид, В203 может быть получен или путем непосредственного соединения бора с кислородом или прокаливанием борной кислоты. Борный ангидрид очень огнестоек и не восстанавливается углем даже при белом калении. В воде он растворяется с образованием в конечном итоге ортоборной кислоты и выделением теплоты:
Вг03(к) + ЗН20(ж) =2НзВ03(р),
ДН = —76,5 кДж.
Ортоборная кислота Н3ВО3 представляет собой белые кристаллы, блестящие чешуйки которых растворяются в горячей воде. В водном растворе ортоборная кислота находится в равновесии с другими кислотами бора:
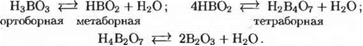
Как правило, из различных кислот одного и того же элемента, отличающихся друг от друга степенью гидратации (т. е количеством связанных молекул воды), наиболее гидратированная форма является наиболее устойчивой в водных растворах. Из приведенных кислот бора наиболее устойчивой в водных растворах является ортоборная кислота. Поэтому в тех случаях, когда в ходе реакции должна получиться какая-либо борная кислота, в водных растворах всегда выделяется ее наиболее устойчивая форма — ортоборная кислота. При охлаждении раствора борная кислота выкристаллизовывается, так как в холодной воде она малорастворима.
Ортоборная кислота принадлежит к числу очень слабых кислот. Менее гидратированные ее формы (НВО2, Н2В4О7) являются также слабыми кислотами, но несколько более сильными, чем ортоборная кислота. Такое правило о большей силе менее гидратированных форм одной и той же кислоты имеет место и в других случаях. Поэтому из слабых кислот бора несколько более сильной является тетраборная кислота.
В результате при попытке нейтрализации водного раствора ортоборной кислоты щелочью получается не ортоборат, а тетраборат щелочного элемента:
4Н3В03 + 2NaOH = Na2B407 + 7HzO.
Соли борных кислот бораты большей частью являются производными не ортоборной кислоты Н3ВО3, а тетраборной и других более бедных водой борных кислот.
Соединения бора с азотом имеют две полиморфные модификации: алмазо- и графитоподобную. Графитоподобная модификация нитрида бора имеет структуру графита , в которой атомы бора чередуются с атомами азота, как в плоскостях, образуемых шестичленными кольцами, так и в перпендикулярных слоям плоскостях.
Билет 2.
2. Оксиды и их гидратные формы элементов V группы.
К главной подгруппе V группы периодической системы принадлежат азот, фосфор, мышьяк, сурьма и висмут.
Эти элементы, имея пять электронов на внешней электронной оболочке атома, характеризуются в целом как неметаллы. Благодаря наличию пяти наружных электронов, высшая положительная степень окисления элементов этой подгруппы равна -1-5, а отрицательная —3.
Оксиды азота.
Азот образует с кислородом ряд оксидов; все они могут быть получены из азотной кислоты или ее солей.
Оксид азота (I), или закись азота, N2О получается при нагревании нитрата аммония:
NH4NO3 =N20  + 2H20.
+ 2H20.
Оксид азота (I) представляет собою бесцветный газ, который используют в качестве наркоза.
Оксид азота (I) — термодинамически неустойчивое соединение. Стандартная энергия Гиббса его образования положительна. Однако вследствие большой прочности связей в молекуле N20 энергии активации реакций, протекающих с участием этого вещества, высоки. В частности, высока энергия активации распада N20. Поэтому при комнатной температуре оксид азота (I) устойчив. Однако при повышенных температурах он разлагается на азот и кислород; разложение идет тем быстрее, чем выше температура.
Ни с водой, ни с кислотами, ни с щелочью оксид азота (I) не реагирует.
Оксид азота(II), или окись азота, N0 представляет собой бесцветный трудно сжижаемый газ.
По химическим свойствам оксид азота (II) относится к числу безразличных оксидов, так как не образует никакой кислоты.
Подобно N20 ОКСИД азота (II) термодинамически неустойчив. При комнатной температуре NO не разлагается, потому что его молекулы достаточно прочны. Лишь при температурах выше 1000 °С его распад на азот и кислород начинает протекать с заметной скоростью.
В лаборатории оксид азота (II) обычно получают взаимодействием 30— 35%-ной азотной кислоты с медью:
3Cu + 8HNO3 = 3Cu(N03)2 + 2NOt + 4Н20.
В промышленности он является промежуточным продуктом при производстве азотной кислоты.
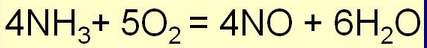
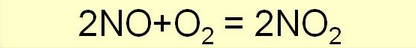
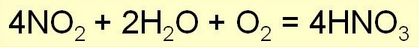
Для оксида азота (II) характерна окислительно-восстановительная двойственность. Под действием сильных окислителей он окисляется, а в присутствии сильных восстановителей — восстанавливается. Например, он легко окисляется кислородом воздуха до диоксида азота:
2NO + 02 = 2N02 .
В то же время смесь равных объемов N0 и Н2 при нагревании взрывается: 2NO(r) + 2Н2(Г) = N2(r) 4- 2Н20(Г), АН = —655 кДж.
Диоксид (или двуокись) азота N02 — бурый ядовитый газ. Изменение окраски диоксида азота при повышении температуры сопровождается и изменением его молекулярной массы.
Диоксид азота — очень энергичный окислитель. Многие вещества могут гореть в атмосфере NO2, отнимая от него кислород.
При растворении в воде NO2 вступает в реакцию с водой, образуя азотную и азотистую кислоты: 2N02 + Н20 = HNO3 + HNO2
Поэтому диоксид азота можно считать смешанным ангидридом этих кислот. Но азотистая кислота очень нестойка и быстро разлагается: 3HN02 = HNOs + 2N0 + Н20.
Поэтому практически взаимодействие диоксида азота с водой, особенно с горячей, идет согласно уравнению 6N02 + 2H20 = 4HN03 + 2N0, которое можно получить сложением двух предыдущих уравнений, если предварительно первое из них умножить на три.
В присутствии воздуха образующийся оксид азота немедленно окисляется в диоксид азота, так что в этом случае NO2 в конечном итоге полностью переходит в азотную кислоту:
4N02 + 02 + 2Н20 = 4HN03
Если растворять диоксид азота в щелочах, то образуется смесь солей азотной и азотистой кислот, например: 2N02 + 2NaOH = NaN03 + NaN02 + H20.
Оксид азота (III), или азотистый ангидрид, N2O3 представляет собой темно-синюю жидкость, уже при низких температурах разлагающуюся на N0 и NO2. Смесь равных объемов N0 и NO2 при охлаждении вновь образует N2O3: NO + NO2 <=* N2O3
Оксиду азота (III) соответствует азотистая кислота HNO2.
Оксид азота (V), или азотный ангидрид, N2O5 — белые кристаллы, уже при комнатной температуре постепенно разлагающиеся на NO2 и О2- Он может быть получен действием фосфорного ангидрида на азотную кислоту: 2HNO3 + P2O5 — N2O5 + 2HPO3
Оксид азота (V) — очень сильный окислитель. В воде оксид азота (V) хорошо растворяется с образованием азотной кислоты.
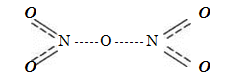 В твердом состоянии.
В твердом состоянии.
Кислоты:
Азотистая кислота.
При действии на раствор какого-нибудь нитрита разбавленной серной кисло-той получается свободная азотистая кислота:
2NaN02 + H2S04 = Na2S04 + 2HN02 .
Она принадлежит к числу слабых и известна только в сильно разбавленных водных растворах. При концентрировании раствора или при его нагревании азотистая кислота распадается:
2HN02 = N0 + N02 + Н20.
HN02 проявляет окислительно-восстановительную двойственность. Под действием восстановителей она восстанавливается (обычно до N0), а в реакциях с окислителями — окисляется до HNO3. Примерами могут служить следующие реакции:
2HN02 + 2KI + H2S04 = 2N0 +I2 + K2S04 + 2H20:
5HN02 + 2KMn04 + 3H2S04 = 5HN03 + 2MnS04 + K2S04 + 3H20.
Азотная кислота.
Читай билет № 4.
Оксиды и кислоты фосфора.
К важнейшим оксидам фосфора принадлежат Р20з и Р205.
Оксид фосфора (III), или фосфористый ангидрид, Р20з получается пре медленном окислении фосфора или когда фосфор сгорает при недостаточном доступе кислорода. Молекулярная масса его при низких температурах соответствует формуле Р406. При действии холодной воды оксид фосфора (III) медленно взаимодействует с ней, образуя фосфористую кислоту Н3РО3. Как оксид фосфора (III), так и фосфористая кислота обладают сильно выраженными восстановительными свойствами.
Оксид фосфора (V), или фосфорный ангидрид, Р205 образуется при горении фосфора на воздухе или в кислороде в виде белой объемистой снегообразной массы.
Оксид фосфора (V) жадно соединяется с водой и потому применяется как очень сильное водоотнимающее средство. На воздухе оксид фосфора (V), притягивая влагу, быстро превращается в расплывающуюся массу метафосфорной кислоты.
Фосфорные кислоты.
Оксиду фосфора (V) отвечает несколько кислот. Важнейшая из них — это ортофосфорная кислота НзР04, называемая обычно просто фосфорной. Другие фосфорные кислоты представляют собою полимерные соединения. В анионе всех фосфорных кислот атом фосфора, находящийся в состоянии «sр3-гибридизации, окружен четырьмя атомами кислорода, расположенными в вершинах тетраэдра. Ортофосфорная кислота построена из изолированных тетраэдров, в других фосфорных кислотах тетраэдры РО4 объединены через атомы кислорода в агрегаты, содержащие от двух до весьма большого числа — порядка 105 — атомов фосфора.
Ортофосфорная кислота не принадлежит к числу сильных кислот. Будучи трехосновной, она образует три ряда солей: средние и кислые с одним или с двумя атомами водорода в кислотном остатке. Средние соли фосфорной кислоты называют ортофосфатами или просто фосфатами, кислые — гидрофосфатами:
В лаборатории фосфорную кислоту можно получать окислением фосфора 30%-ной HNO3. Реакция протекает согласно уравнению:
ЗР + 5HN03 + 2Н20 = ЗН3РО4 + 5N0
В промышленности фосфорную кислоту получают двумя методами: экстракционным и термическим. В основе экстракционного метода лежит обработка природных фосфатов серной кислотой:
Са3(Р04)2 + 3H2S04 = 3CaS04 + 2Н3Р04
Все другие фосфорные кислоты представляют собой продукты соединения тетраэдров Р04. В большинстве своем эти кислоты не выделены в свободном состоянии, а известны в виде смесей, в водных растворах или в виде солей.
Дата добавления: 2016-10-07; просмотров: 3039;











