АМИДЫ СУЛЬФАНИЛОВОЙ КИСЛОТЫ (СУЛЬФАНИЛАМИДНЫЕ ПРЕПАРАТЫ)
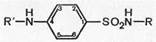
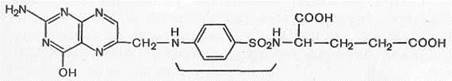
Сульфаниловая кислота (I) не применяется в медицинской практике, но ее амид (II) является лекарственным средством (белый стрептоцид) и служит источником для получения большого числа лекарственных препаратов, объединенных по своему химическому строению и характеру лечебного действия в одну большую группу сульфаниламидных препаратов с общей формулой (III):
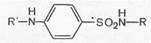
где R и R' — различные заместители.
Открытие сульфаниламидных препаратов было связано с текстильной промышленностью, когда в поисках лучших красителей тканей французский химик Гельмо (1909) синтезировал гс-аминобензолсульфамид как источник для получения красителя.
После того как стало известно, что красители проявляют антимикробную активность, немецкий ученый Домагк (1932) получил азокраситель, названный им пронтозилом, который проявлял высокую терапевтическую активность при тяжелых стрептококковых инфекциях.
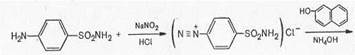
Это открытие послужило началом нового этапа в развитии химиотерапии.
Основной задачей химиотерапии является изыскание средств борьбы с инфекционными заболеваниями. Химиотерапевтическими средствами называются такие вещества, которые избирательно действуют на патогенные микроорганизмы и почти не действуют в тех же концентрациях на микроорганизм.
Основные положения химиотерапии впервые сформулировал русский ученый Д. Л. Романовский (1891).
В нашей стране создание отечественных сульфаниламидов относится к 1935—1936 гг. В эти годы появились первые работы в области синтеза и изучения терапевтических свойств сульфаниламидов, выполненные во ВНИХФИ им. С. Орджоникидзе под руководством известного химика-органика О. Ю. Магидсона. Первым сульфаниламидным препаратом, созданным советскими химиками (О. Ю. Магидсон и М. В. Рубцов), был красный стрептоцид, близкий по химической структуре к пронтозилу.
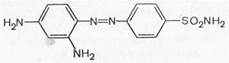
Пронтозил
Вскоре было установлено, что пронтозил, а следовательно, и близкий к нему красный стрептоцид расщепляются в организме животного с образованием двух продуктов: сульфаниламида (I) (высокоактивное в терапевтическом отношении вещество) и 1,2,4-три-аминобензола (II) (токсический, физиологически неактивный продукт).
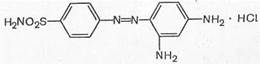
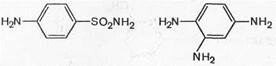
Это наблюдение заставило отказаться от соединений типа пронтозила и красного стрептоцида и уделить основное внимание продукту его расщепления. С этого времени /г-аминобензолсульфамид (I) получил признание во всем мире.
В нашей стране он был введен в медицинскую практику с 1936 г. под названием «белый стрептоцид» в отличие от ранее созданного «красного стрептоцида».
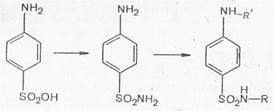
Таким образом, белый стрептоцид (ныне его фармакопейное название стрептоцид) является родоначальником всей группы сульфаниламидных препаратов, на основе которого путем замены на различные радикалы водорода в сульфамидной группе (положение 1) и ароматической аминогруппе (положение 4) было получено множество сульфаниламидных препаратов с разной степенью терапевтической активности.
Развитие работ по синтезу сульфаниламидных препаратов как в нашей стране, так и за рубежом шло необыкновенно быстрыми темпами, особенно в первое десятилетие с момента их открытия.
К этому времени на вооружении медицины были следующие сульфаниламидные препараты.
Стрептоцид 
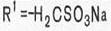
Основные закономерности этой связи сводятся к следующему.
1. Физиологическая активность сульфаниламидов обусловлена наличием сульфанильного радикала в молекуле.
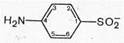
2. Перемещение аминогруппы из положения 4 в другие положения ароматического ряда приводит к полной потере физиологической активности.
Любое производное сульфаниламида с замещенной аминогруппой в положении 4 может быть физиологически активным лишь в том случае, если в орга низме может снова образоваться свободная аминогруппа.
4. Введение в ароматическое ядро дополнительныхзаместителей либо снимает, либо уменьшает физиологическую активность.
5. При введении различных радикалов в сульфамидную группу молекулы физиологическая активность может меняться в зависимости от характера радикала либо в сторону увеличения, либо уменьшения.
6. Для обеспечения длительного действия существенное значение имеет наличие в молекуле метоксильных групп (почти все ЛС длительного действия в отличие от ЛС непродолжительного действия имеют метоксильные группы -ОСН3 в гетероциклическом ядре -R).
Предполагают, что метоксигруппа определяет более высокий процент связывания сульфаниламида с белками плазмы, что и обусловливает длительность действия препарата.
Механизм антимикробного действия сульфаниламидов связан с их конкурентным антагонизмом с я-ами-нобензойной кислотой (ПАБК).
Для нормальной жизнедеятельности и роста многих микроорганизмов необходима фолиевая кислота, которая синтезируется в микробной клетке из ПАБК, глутаминовой кислоты и птерина
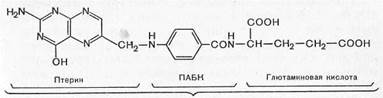
Фолиевая нислота
Так как сульфаниламиды имеют близкое химическое структурное сходство с ПАБК, они захватываются микробной клеткой вместо /г-аминобензойной кислоты, нарушая тем самым синтез фолиевой кислоты. Образующееся соединение, лишенное ПАБК, не может быть дальше использовано микробной клеткой в качестве питательного фермента, и рост микроорганизмов приостанавливается.
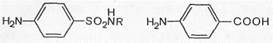
Сульфаниламид (вместо ПАБН)
Таким образом, в отличие от веществ бактерицидных или антисептических, которые убивают микроорганизмы за счет денатурации их белков, сульфаниламиды оказывают бактериостатическое действие, что связано с нарушением биосинтеза фолиевой кислоты — жизненно необходимого ростового компонента для микроорганизмов.
Все сульфаниламидные препараты представляют собой кристаллические порошки белого или слегка желтоватого цвета, без запаха. Кислотные формы их плохо растворимы в воде, но хорошо растворимы в некоторых органических растворителях — этаноле, ацетоне. Каждый препарат обладает характерной температурой плавления. Натриевые соли сульфаниламидов хорошо растворимы в воде и нерастворимы в органических растворителях.
Имея близкую химическую структуру, сульфаниламидные препараты обладают рядом общих химических свойств, обусловливающих общие реакцииих идентификации. В основном эти общие реакции обусловлены наличием трех функциональных групп: ароматических аминогруппы, сульфогруппы, и имидной группы.
Некоторые реакции присущи ароматическому ядру.
Большинство сульфаниламидов являются амфотерными веществами — у них выражены и кислотные, и основные свойства. Последние обусловлены наличием аминогруппы в ароматическом ядре. Как основания они могут растворяться в кислотах с образованием солей.
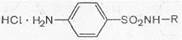
Однако соли их в водных растворах сильно гидро-лизованы и практически не существуют.
Кислотные свойства сульфаниламидов обусловлены наличием атома водорода имидной группы, который способен замещаться на металлы с образованием солей. Поэтому в большинстве своем сульфаниламидные препараты легко растворяются и в гидроксидах щелочных металлов, и в карбонатах.
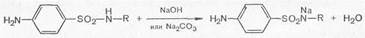
Кислотные свойства сульфаниламидов выражены сильнее, чем основные.
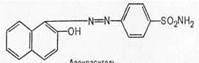
1. Реакции, обусловленные ароматической аминогруппой —NH2: а) реакция диазотирования и азосочетания с фенолами (реакция ГФ); при действии на сульфаниламид нитритом натрия в кислой среде образуется соль диазония, которая при сочетании с фенолом в щелочной среде образует азокраситель.
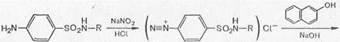
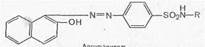
Сульфаниламиды с замещенной аминогруппой, например стрептоцид растворимый, фталазол, фтазин, дают эту реакцию после предварительного гидролиза, который проводят при нагревании с разведенной хлороводородной кислотой;
б) реакция конденсации с альдегидами (образование окрашенных оснований Шиффа); сульфаниламидные препараты, как и другие ароматические амины, со многими альдегидами образуют окрашенные продукты конденсации типа оснований Шиффа, что широко используется в фармацевтическом анализе для целей идентификации ароматических аминов. Реакция протекает в кислой среде.
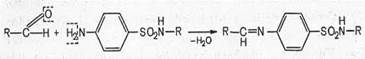
Основание Шиффа (окрашено)
В зависимости от характера альдегида, вступающего во взаимодействие с сульфаниламидом, цвет получающихся продуктов конденсации различный.
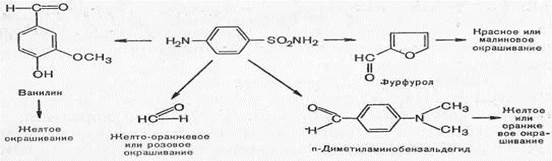
2. Реакции, обусловленные сульфогруппой -SO2. Все сульфаниламидные препараты имеют в своем составе серу сульфамидной группы. Для открытия серы необходимо окислить органическую часть молекулы концентрированной азотной кислотой, при этом сера переходит в сульфатную, которую легко можно обнаружить с раствором хлорида бария.
3. Реакции, обусловленные имидной группой -NH. Атом водорода имидной группы обусловливает возможность взаимодействия сульфаниламидов с солями тяжелых металлов (CuSO4; СоС12 и др.). Получаемые соединения представляют собой окрашенные вещества, растворимые или нерастворимые в воде. При этом цвет осадка или раствора для каждого сульфаниламидного препарата различный, что дает возможность отличать один препарат от другого. Это характеризует
данную реакцию как частную, позволяющую определять индивидуальность препарата.
Реакция эта выполняется с натриевыми солями сульфаниламидов. Сульфаниламид сначала нейтрализуют раствором гидроксида натрия, затем добавляют раствор соли тяжелого металла. Следует избегать избытка гидроксида натрия, так как в этом случае может образовываться гидроксид металла, который будет маскировать основную реакцию.
ГФ для нейтрализации имидной группы рекомендует определенное, установленное опытом количество гидроксида натрия, необходимое для образования натриевой соли.
3. Реакции, обусловленные ароматическим ядром. Имея ароматическое ядро, сульфаниламиды могут галоидироваться, нитроваться, сульфироваться.
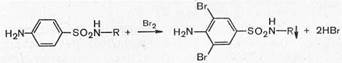
Для фармацевтического анализа имеют значение нитропроизводные сульфаниламидов, поскольку они окрашены в желтый цвет, и бромпроизводные, которые нерастворимы в воде и выпадают в осадок.
5. Реакции, основанные на термическом разложении - пиролизе. При термическом разложении, т. е. при нагревании сухого порошка сульфаниламидных препаратов, образуются различные кристаллические возгоны и плавы, окрашенные в большинстве случаев в темно-бурый цвет. Исключение составляют стрептоцид, сульгин и уросульфан, плавы которых окрашены в фиолетово-красный цвет. Эта реакция является общей для всех сульфаниламидов, но в то же время и частной, так как в ряде случаев цвет плава индивидуален для того или другого препарата.
Если в молекуле препарата имеется сера в гетероциклическом ядре (норсульфазол, фталазол, этазол и др.), при пиролитическом расщеплении выделяется газообразный продукт H2S, который можно определить по запаху или по почернению фильтровальной бумажки, смоченной раствором ацетата свинца (PbS).
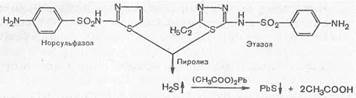
При пиролизе сульфаниламидных препаратов, не содержащих серу в ядре (сульфадимезин, сульфацил й др.), образуется диоксид серы SO2f.
Частные реакции на СААМ определяются преимущественно характером радикалов R и R'.
Методы количественного определениясульфаниламидных препаратов основываются на их химических свойствах и характере функциональных групп. Общим методом количественного определения сульфаниламидных препаратов, рекомендуемым ГФ, является метод нитритометрии.
Данный метод основан на способности сульфаниламидов образовывать диазосоединения. Стандартным раствором служит нитрит натрия. Конец титрования устанавливается либо по внешнему индикатору (йод-крахмальная бумажка), либо по внутреннему (тропеолин-00), либо потенциометрически.
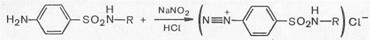
Кроме метода, принятого ГФ, для количественного определения сульфаниламидных препаратов можно использовать и другие методы:
а) метод нейтрализации, основанный на способности сульфаниламидов проявлять кислотные свойства, обусловленные наличием атома водорода имидной группы; кислотные формы сульфаниламидов титруются в спиртовой среде раствором гидроксида натрия или калия с индикатором тимолфталеином.
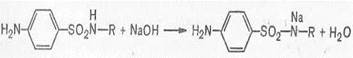
Учитывая слабые кислотные свойства сульфаниламидов, можно применить титрование в неводном растворителе, например диметилформамиде.
Соли сульфаниламидов, как, например, сульфацил-натрий, титруются кислотой в спиртоацетоновой среде в присутствии метилового оранжевого;
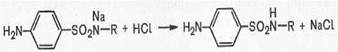
б) броматометрический метод, основанный на способности сульфаниламидов галоидироваться; стандартным раствором служит бромат калия, титрование ведется в кислой среде в присутствии бромида калия. Избыток брома определяется иодометрически;

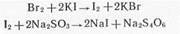
в) фотоколориметрический метод, основанный на способности сульфаниламидов давать окрашенные продукты реакции с альдегидами, солями тяжелых металлов; для данного метода могут быть использованы и азокрасители.
Сравнивая интенсивность окраски исследуемого раствора со стандартным раствором, можно судить о количестве вещества в препарате.
Все сульфаниламидные препараты хранятся по списку Б в хорошо укупоренной таре. Натриевые соли следует хранить в условиях, исключающих действие влаги и света, вследствие возможного гидролиза.
Высшая разовая доза внутрь всех СААМ короткого действия 2 г, высшая суточная - 7 г
Дата добавления: 2016-06-22; просмотров: 9849;











