Закон равномерного распределения энергии по степеням свободы молекул
Закон доказан Л.Больцманом[26] методом классической статистической физики, исходя из предположения, что движение молекул подчиняется законам классической механики:
Для статистической системы, которая находится в состоянии термодинамического равновесия на каждую поступательную и вращательную степени свободы молекулы в среднем приходится одинаковая кинетическая энергия, равная 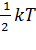 ,
,
где 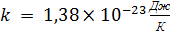 – постоянная Больцмана[27].
– постоянная Больцмана[27].
Если молекула имеет  степеней свободы, то её средняя кинетическая энергия равна:
степеней свободы, то её средняя кинетическая энергия равна: 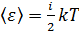 .
.
Закон Больцмана лежит в основе всей теоpии идеальных газов. Однако, закон оказался неточным, т.к. молекулы – квантовые частицы.
1.10. Закон Максвелла[28] о распределении молекул идеального газа по скоростям
Понятие о функции распределения
Фу́нкция распределе́ния в теории вероятностей– функция, характеризующая распределение случайной величины или случайного вектора; вероятность того, что случайная величина 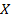 примет значение, меньшее, чем
примет значение, меньшее, чем 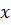 , где
, где 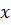 – произвольное действительное число.
– произвольное действительное число.
Функция распределения, основное понятие статистической физики; характеризует плотность вероятности распределения частиц статистической системы по фазовому пространству т.е. по координатам 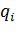 и импульсам
и импульсам 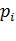 в классической статистической физике или вероятность распределения по квантовомеханическим состояниям в квантовой статистике.
в классической статистической физике или вероятность распределения по квантовомеханическим состояниям в квантовой статистике.
Распределение Ма́ксвелла – распределение вероятности, встречающееся в физике и химии. Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию.
Функция распределения молекул идеального газа по скоростям
Закон распределения молекул идеального газа по скоростям, теоретически полученный Максвеллом в 1860 г. определяет, какое число 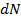 молекул однородного
молекул однородного 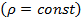 одноатомного идеального газа из общего числа
одноатомного идеального газа из общего числа 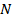 его молекул в единице объёма имеет при данной температуре
его молекул в единице объёма имеет при данной температуре 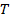 скорости, заключенные в интервале от
скорости, заключенные в интервале от 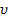 до
до 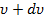 .
.
Идеальный газ – система из большого числа свободных невзаимодействующих частиц, находящихся в непрерывном хаотическом движении, часто сталкивающихся друг с другом. Поэтому в газе при постоянных внешних параметрах устанавливается равновесное состояние, которому соответствует определённое распределение частиц в пространстве по направлениям движения и скоростям. При равновесии средние скорости и число частиц, движущихся в разных направлениях, оказывается одинаковым, о чём свидетельствует отсутствие направленного потока газа при равновесии.
Абсолютная величина скорости молекул, а также проекции скорости на любую ось могут принимать непрерывные значения от нуля до бесконечности. Значит, должна существовать непрерывная функция распределения скоростей 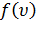 , показывающая относительное количество молекул, движущихся в единичном интервале скоростей со скоростью, близкой к скорости
, показывающая относительное количество молекул, движущихся в единичном интервале скоростей со скоростью, близкой к скорости 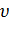 .
.
На языке теории вероятности, 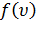 есть плотность вероятности того, что молекула имеет скорость, лежащую в интервале от
есть плотность вероятности того, что молекула имеет скорость, лежащую в интервале от 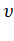 до
до 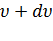 . Тогда сама вероятность описывается выражением:
. Тогда сама вероятность описывается выражением: 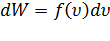 .
.
Нахождение функции распределения 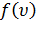 молекул по скоростям является главной задачей молекулярно-кинетической теории. Это объясняется тем, что согласно теории вероятности любой функции
молекул по скоростям является главной задачей молекулярно-кинетической теории. Это объясняется тем, что согласно теории вероятности любой функции 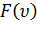 (это может быть внутренняя энергия, длина свободного пробега или любая другая функция состояния газа) определяется следующим интегралом:
(это может быть внутренняя энергия, длина свободного пробега или любая другая функция состояния газа) определяется следующим интегралом:
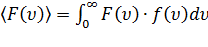 .
.
Впервые найти функцию распределения по скоростям удалось Д.Максвеллу, который исходил из следующих предположений:
1) Идеальный газ состоит из большого числа  одинаковых молекул;
одинаковых молекул;
2) Температура газа постоянна 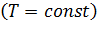 ;
;
3) Молекулы газа совершают тепловое хаотическое движение;
4) На газ не действуют силовые поля.
Функция распределения молекул по скоростям 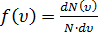 определяет относительное число молекул
определяет относительное число молекул 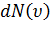 , скорости которых лежат в интервале от
, скорости которых лежат в интервале от 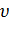 до
до 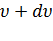 .
.
Используя методы теории вероятностей, Максвелл нашел функцию 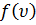 –закон распределения молекул идеального газа по скоростям:
–закон распределения молекул идеального газа по скоростям:
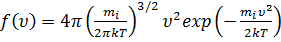 ,
,
где 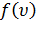 зависит от рода газа (
зависит от рода газа ( 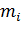 –масса молекулы) и от параметров состояния (температуры
–масса молекулы) и от параметров состояния (температуры 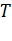 ).
).
Дата добавления: 2016-09-26; просмотров: 3080;











