I.1.1 ПРЕДМЕТ МОЛЕКУЛЯРНОЙ ФИЗИКИ
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ
ИДЕАЛЬНЫХ ГАЗОВ
I.1.1 ПРЕДМЕТ МОЛЕКУЛЯРНОЙ ФИЗИКИ
Молекулярная физика – изучает зависимости строения и физических свойств тел от характера теплового движения и взаимодействия между частицами, из которых состоят тела.
Молекулярная физика основывается на молекулярно-кинетической теории строения вещества. В основе этой теории лежат три важнейших положения, которые полностью подтверждены экспериментально и теоретически:
– все тела состоят из частиц – молекул, атомов и ионов, в состав которых входят более мелкие элементарные частицы;
– атомы, молекулы и ионы находятся в непрерывном хаотическом движении, которое называется тепловым движением;
– между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Экспериментальными подтверждениями молекулярно– кинетической теории являются диффузия, броуновское движение, явление переноса в различных агрегатных состояниях вещества, а также современные методы изучения строения веществ (рентгенография, электронография, нейтронография, электронная микроскопия).
Диффузия – процесс выравнивания плотностей (или концентраций) двух веществ, при их смешивании друг с другом. Взаимное проникновение веществ является результатом беспорядочного движения их частиц и изменения плотности вдоль какого-либо направления. В этом направлении и происходит диффузия. Диффузия наблюдается в газах, жидкостях и твердых телах.
Броуновское движение - непрерывное хаотическое движение частиц под влиянием ударов молекул окружающей среды, помещенных в жидкость или газ в такие условия, что сила тяжести не влияет на их движение (взвешенные частицы).
Атом - наименьшая частица данного химического элемента. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в электрическом поле ядра. Электрический заряд ядра равен абсолютной величине суммарного заряда всех электронов атома, поэтому атом является электрически нейтральным.
Молекула – наименьшая устойчивая частица данного вещества, обладающая его основными химическими свойствами.
Для характеристики масс атомов и молекул используются величины, называемые относительной атомной массой (или просто атомной массой) химического элемента и относительной молекулярной массой (или просто молекулярной массой) вещества.
Относительная атомная масса (Аr) химического элемента – отношение массы атома этого элемента к 1/12 массы атома 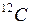 .
.
Относительная молекулярная масса (Мr) вещества – отношение массы молекулы этого вещества к 1/12 массы атома 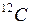 . Атомная и молекулярная массы являются безразмерными величинами.
. Атомная и молекулярная массы являются безразмерными величинами.
Атомная единица массы (а.е.м.) - масса, равная 1/12 массы атома 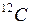 . Одной из основных единиц СИ является единица количества вещества, называемая молем. Моль – это количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг изотопа углерода
. Одной из основных единиц СИ является единица количества вещества, называемая молем. Моль – это количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг изотопа углерода 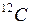 .
.
Постоянная Авогадро ( 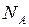 ) – число частиц, содержащихся в моле вещества. Опытным путём найдено, что эта постоянная равна
) – число частиц, содержащихся в моле вещества. Опытным путём найдено, что эта постоянная равна 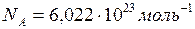 .
.
Существует два способа описания процессов, происходящих в макроскопических телах (т.е. телах, состоящих из очень большого числа частиц – атомов или молекул), – статистический и термодинамический.
Статистический метод основан на использовании теории вероятностей и определённых моделей строения изучаемых систем.
Термодинамический метод основан на описании состояния системы в целом без учета внутреннего строения и на изучении различных превращений энергии, происходящих в системе. Условия этих превращений и соотношения между разными видами энергий позволяют изучать физические свойства исследуемых систем при самых разнообразных процессах, в которых эти системы участвуют.
Дата добавления: 2016-09-06; просмотров: 3399;











