Количество вещества. Масса молекул
Количество вещества 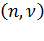 –физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе.
–физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе.
Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в Международной системе единиц (СИ)–моль.
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии, при изучении процессов электролиза, или в термодинамике, при описании уравнений состояния идеального газа.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Например, для реакции горения водорода 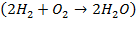 требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода). Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода). Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул «в штуках», их измеряют в молях.
Моль – количество вещества, содержащее столько же молекул (атомов, ионов), сколько атомов содержится в 0,012 кг изотопа углерода 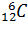 .
.
Число частиц, содержащихся в моле вещества, называется постоянной Авогадро[25]: 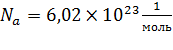 .
.
В моле любого вещества (твёрдого, жидкого, газообразного) содержится одинаковое количество молекул, равное 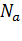 .
.
Моль – это количество вещества, содержащее 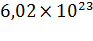 атомов или молекул этого вещества.
атомов или молекул этого вещества.
Так как массы различных молекул отличны друг от друга, то одинаковые количества различных веществ имеют разную массу.
Массу моля называют молярной массой: 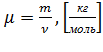 , где
, где 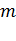 – масса вещества.
– масса вещества.
Относительная молекулярная масса 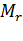 – величина безразмерная:
– величина безразмерная:
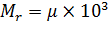 .
.
Если 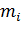 –масса одной
–масса одной  – той молекулы, то
– той молекулы, то 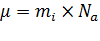 .
.
Число молекул, содержащихся в произвольной массе вещества:
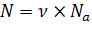 .
.
По закону Авогадро, количество газообразного вещества так же можно определить на основании его объёма: 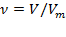 , где
, где 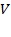 – объём газа (при нормальных условиях),
– объём газа (при нормальных условиях), 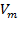 –молярный объём газа при н. у., равный 22,4 л/моль.
–молярный объём газа при н. у., равный 22,4 л/моль.
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества:
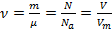 .
.
Молярная масса численно всегда совпадает с молекулярной массой (или атомной массой –если вещество состоит не из молекул, а из атомов). В таблице 1 для иллюстрации приведены молярные массы 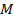 для нескольких веществ разного строения.
для нескольких веществ разного строения.
Таблица 1. Молярные массы различных веществ
| Вещество | Молекулярная или атомная масса (округлена) | молярная масса
|
Вода 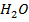
| 18 а.е.м. | 18 кг/моль |
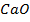
| 56 а.е.м. | 56 кг/моль |
Углерод 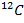
| 12 а.е.м. | 12 кг/моль |
Медь 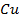
| 63,5 a.e.м. | 63,5 кг/моль |
Молекула хлора 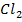
| 71 а.е.м. | 71 кг/моль |
Количественно масса 1 моль вещества –масса вещества в граммах, численно равная его атомной или молекулярной массе.
Пример: молекулярная масса воды 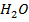 равна 18 а.е.м. (атомная масса водорода –1, кислорода –16, итого 1+1+16=18). Значит, один моль воды равен по массе 18 граммов, и эта масса воды содержит
равна 18 а.е.м. (атомная масса водорода –1, кислорода –16, итого 1+1+16=18). Значит, один моль воды равен по массе 18 граммов, и эта масса воды содержит 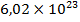 молекул воды.
молекул воды.
Итак, один моль любого вещества содержит 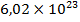 молекул, атомов или других частиц.
молекул, атомов или других частиц.
Например, 1 моль воды 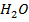 содержит
содержит 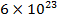 молекул
молекул 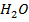 ;
;
1 моль железа 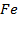 содержит
содержит 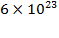 атомов
атомов 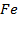 .
.
1 моль хлора 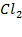 содержит
содержит 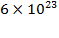 молекул
молекул 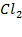 .
.
В то же время 1 моль хлора 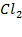 содержит 2 моль атомов хлора
содержит 2 моль атомов хлора 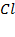 .
.
Идеальный газ
Идеальный газ – математическая модель газа, в которой предполагается, что: 1)потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией; 2) суммарный объём молекул газа пренебрежимо мал; 3) между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упругие; 4) время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
В расширенной модели идеального газа частицы, из которого он состоит, имеют форму упругих сфер или эллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми– Дирака или Бозе – Эйнштейна).
Идеальный газ реально не существует.
Дата добавления: 2016-09-26; просмотров: 3094;











