Вывод распределения по Максвеллу
Получим теперь формулу распределения так, как это делал сам Джеймс Клерк Максвелл.
Рассмотрим пространство скоростных точек (каждую скорость молекулы представляем как точку (скоростную точку) в системе координат 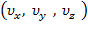 встационарном состоянии газа. Выберем бесконечно малый элемент объема
встационарном состоянии газа. Выберем бесконечно малый элемент объема 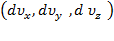 .Так как газ стационарный, количество скоростных точек в
.Так как газ стационарный, количество скоростных точек в 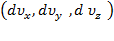 остается неизменным с течением времени. Пространство скоростей изотропно, поэтому функции плотности вероятности для всех направлений одинаковы.
остается неизменным с течением времени. Пространство скоростей изотропно, поэтому функции плотности вероятности для всех направлений одинаковы.
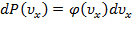 ,
, 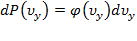 ,
, 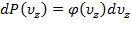 .
.
Максвелл предположил, что распределения скоростей по направлениям статистически независимы, то есть компонента 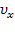 скорости молекулы не зависит от
скорости молекулы не зависит от 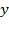 и
и  –компонент.
–компонент.
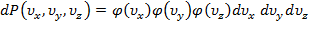
–фактическая вероятность нахождения скоростной точки в объёме 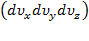 ,где
,где 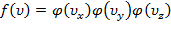 .Прологарифмируем последнее равенство:
.Прологарифмируем последнее равенство:
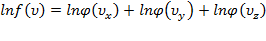 .
.
Дифференцируя полученное выражение по компоненте скорости 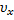 , получим:
, получим:
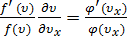 ,
,
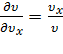 ,
,
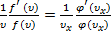 .
.
Правая часть не зависит от 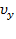 и
и 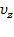 , значит и левая от
, значит и левая от 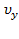 и
и 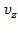 не зависит. Однако,
не зависит. Однако, 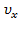 и
и 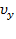 равноправны, следовательно, левая часть не зависит также и от
равноправны, следовательно, левая часть не зависит также и от 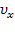 . Значит, данное выражение может лишь равняться некоторой константе.
. Значит, данное выражение может лишь равняться некоторой константе.
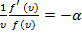 ,
,
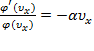 ,
,
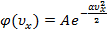 .
.
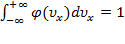 .
.
Следовательно, 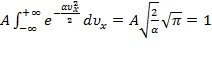 .
.
Отсюда: 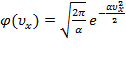 .
.
Теперь нужно сделать принципиальный шаг – ввести температуру. Кинетическое определение температуры (как меры средней кинетической энергии движения молекул):
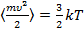 ,
,
где 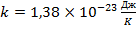 –постоянная Больцмана;
–постоянная Больцмана; 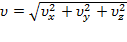 . Ввиду равноправия всех направлений:
. Ввиду равноправия всех направлений: 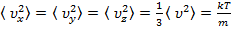 .
.
Чтобы найти среднее значение 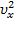 , проинтегрируем её вместе с функцией плотности вероятности от минус до плюс бесконечности:
, проинтегрируем её вместе с функцией плотности вероятности от минус до плюс бесконечности:
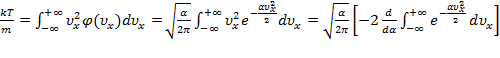 .
.
Отсюда найдём  :
: 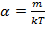 .
.
Функция распределения плотности вероятности для 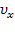 (аналогично для
(аналогично для 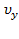 ;
; 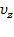 ):
): 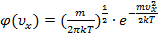 .
.
Теперь рассмотрим распределение по величине скорости. Вернемся в пространство скоростных точек. Все точки с модулем скорости 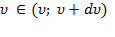 лежат в шаровом слое радиуса
лежат в шаровом слое радиуса  и толщины
и толщины 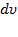 , и
, и 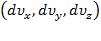 –объем этого шарового слоя.
–объем этого шарового слоя.
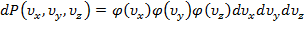 .
.
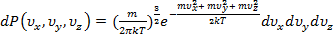 .
.
Учтём, что: 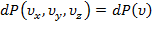 ;
; 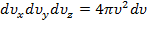 , получим:
, получим:
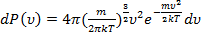 ,
,
где 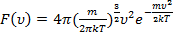 .Тогда окончательно получим:
.Тогда окончательно получим: 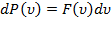 .
.
Таким образом, мы получили функцию плотности вероятности 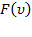 , которая и является распределением Максвелла.
, которая и является распределением Максвелла.
Дата добавления: 2016-09-26; просмотров: 1865;











