Среднеквадратичная скорость
Подставляя 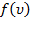 и интегрируя, мы получим:
и интегрируя, мы получим:
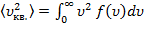 .
.
Откуда следует, что 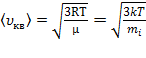 .
.
Таким образом, скорости, которые характеризуют состояние газа:
1) наиболее вероятная 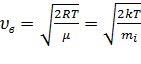 ,
,
2) средняя 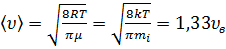 ,
,
3)средняя квадратичная 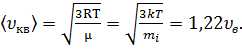
Экспериментальная проверка закона распределения Максвелла –опыт Штерна
Вдоль оси внутреннего цилиндра натянута платиновая посеребренная проволока, через которую пропускают электрический ток. Она нагревается, при нагревании серебро испаряется, атомы серебра вылетают через щель в стенке цилиндра и оседают на внутренней поверхности второго цилиндра оставляя след в виде узкой полоски, параллельной щели. Если оба цилиндра неподвижны, то все атомы независимо от их скорости попадают в одно и то же место: точка  (рис. 113, а) и полоска имеет одинаковую толщину.
(рис. 113, а) и полоска имеет одинаковую толщину.
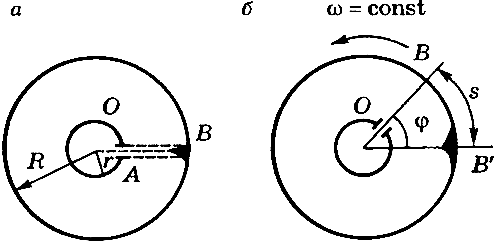 Рис.113.
Рис.113.
|
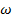 атомы серебра попадут в точки
атомы серебра попадут в точки 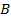 ,
, 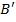 и так далее. По величине
и так далее. По величине 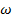 , расстояния между цилиндрами
, расстояния между цилиндрами 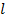 и смещению
и смещению 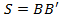 можно вычислить скорость атомов, попавших в точку
можно вычислить скорость атомов, попавших в точку 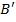 .
.
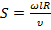 ;
; 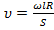 .
.
Изображение щели получается размытым. Исследуя толщину осаждённого слоя, можно оценить распределение молекул по скоростям, которое соответствует максвелловскому распределению.
1.11. Основное уравнение молекулярно – кинетической теории (уравнение Клаузиуса[29])
Рассмотрим идеальный газ в равновесном состоянии, вне силовых полей внутри куба с ребром 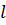 . Давление газа на грани куба обусловлен6о ударами молекул.
. Давление газа на грани куба обусловлен6о ударами молекул.
Упрощённое доказательство уравнения
Молекулы движутся беспорядочно, поэтому все направления их движения равновероятны: 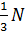 молекул из их общего числа
молекул из их общего числа 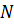 будет двигаться между каждыми двумя гранями куба.
будет двигаться между каждыми двумя гранями куба.
Обозначим: 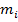 –масса молекулы,
–масса молекулы, 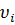 –скорость молекулы,
–скорость молекулы, 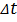 – время удара молекулы о стенку,
– время удара молекулы о стенку, 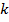 – количество ударов
– количество ударов 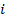 – той молекулы о стенку за некоторое время
– той молекулы о стенку за некоторое время 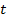 ;
; 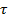 –время между двумя последовательными соударениями молекулы со стенкой.
–время между двумя последовательными соударениями молекулы со стенкой.
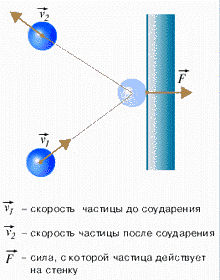 Рис. 114.
Рис. 114.
|
Считаем молекулы классическими частицами, удары молекул о стенку упругими. По второму закону Ньютона сила удара
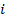 – той молекулы о стенку (рис. 114):
– той молекулы о стенку (рис. 114):
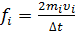 (1)
(1)
За время 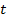 молекула ударит о стенку
молекула ударит о стенку 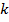 раз и передаст ей импульс
раз и передаст ей импульс 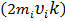 .
.
Средняя сила, действующая на стенку со стороны 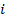 – той молекулы:
– той молекулы:
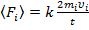 , (2)
, (2)
где 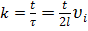 , т.к.
, т.к. 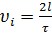 .
.
Получаем: 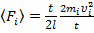 .
.
Средняя (за время 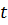 ) сила давления
) сила давления 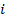 – той молекулы на стенку:
– той молекулы на стенку:
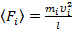 . (3)
. (3)
Т.к. разные молекулы движутся с различными скоростями, то давление со стороны всей совокупности молекул, движущихся между двумя противоположными стенками:
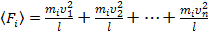 . (4)
. (4)
Т.к. 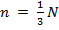 – число молекул, движущихся между двумя противоположными гранями куба, то (4) примет вид:
– число молекул, движущихся между двумя противоположными гранями куба, то (4) примет вид:
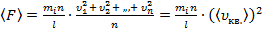 ,
,
или
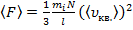 (5)
(5)
Разделим выражение (5) на 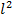
Получим:
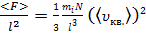 , (6)
, (6)
где 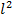 – площадь грани куба,
– площадь грани куба, 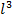 –объём куба.
–объём куба.
Тогда (6) примет вид: 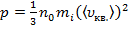 ,
,
где 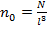 – концентрация молекул. Умножим и разделим последнее выражение на 2. Тогда:
– концентрация молекул. Умножим и разделим последнее выражение на 2. Тогда:
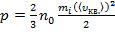 , (7)
, (7)
где 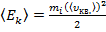 – средняя кинетическая энергия поступательного движения молекул.
– средняя кинетическая энергия поступательного движения молекул.
Тогда уравнение (7) примет вид:
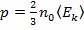 . (8)
. (8)
Уравнение (8) – основное уравнение МКТ (уравнение Клаузиуса):
давление идеального газа прямо пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
Учтём, что
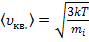 . (9)
. (9)
Подставив (9) в (7), получим: 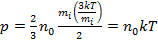 ,
,
т.е. в итоге получаем:
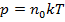 . (10)
. (10)
Уравнение (10) – уравнение состояния идеального газа:
давление идеального газа пропорционально концентрации молекул газа и его абсолютной температуры.
Из уравнений (8) и (10) следует:
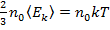 ,
,
следовательно: 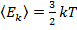 ,
,
т.е. абсолютная температура является мерой средней кинетической энергии теплового поступательного движения молекул.
1.12. Уравнение Менделеева[30] - Клапейрона[31]
Уравнение Менделеева – Клапейрона –уравнение состояния идеального газа, устанавливающее связь между его объемом  ,давлением
,давлением 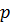 и абсолютной температурой
и абсолютной температурой 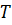 .
.
Рассматриваем идеальный газ. Уравнение состояния идеального газа:
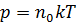 ,
,
умножим последнее выражение на 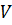 , где
, где 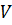 – объём газа.
– объём газа.
Получаем: 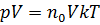 . Учтём, что
. Учтём, что 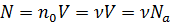 ,
, 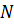 – число частиц газа, где
– число частиц газа, где 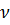 –число молей газа,
–число молей газа, 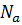 – постоянная Авогадро.
– постоянная Авогадро.
Тогда получаем: 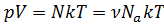 , где
, где 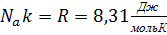 – универсальная газовая постоянная.
– универсальная газовая постоянная.
Окончательно получаем: 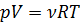 .
.
Последнее уравнение является уравнением состояния идеального газа и называется уравнением Менделеева – Клапейрона.
Частные случаи уравнения Менделеева – Клапейрона
Рассматриваем идеальный газ постоянной массы 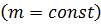 :
:
Изотермический процесс – процесс, протекающий в системе постоянной массы при постоянной температуре 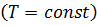 .
.
Процесс описывается законом Бойля[32]–Мариотта[33]: произведение объёма данной массы газа на его давление постоянно при постоянной температуре: 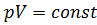 .
.
Изобарный процесс – процесс, протекающий в системе постоянной массы при постоянном давлении 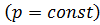 .
.
Процесс описывается законом Гей – Люссака[34]: отношение объёма данной массы газа его абсолютной температуре при постоянном давлении есть величина постоянная:
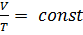 .
.
Изохорный процесс – процесс, протекающий в системе постоянной массы при постоянном объёме 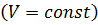 .
.
Процесс описывается законом Шарля[35] : отношение давление данной массы газа при постоянном объемё его абсолютной температуре есть величина постоянная:
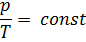
Закон Дальтона[36]
В состоянии теплового равновесия давление в смеси идеальных газов равно сумме давлений каждой компоненты смеси:
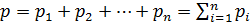 .
.
Дата добавления: 2016-09-26; просмотров: 2306;











