Вторичная структура белка. Типы вторичной структуры, их особенности.
Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей. Вторичная структура образуется только при участии водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т.д.
Можно выделить два возможных варианта регулярных вторичных структур: α-спираль (α-структура) и β-складчатый слой (β-структура). В одном белке, как правило, одновременно присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
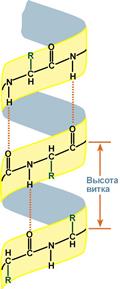
α-спиральхарактеризуется витками вокруг оси молекулы, один виток составляет 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм, спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали.
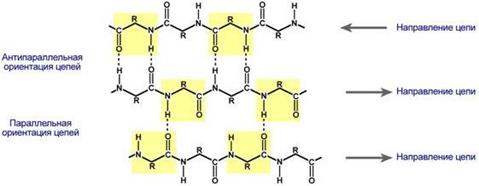
β-складчатый слой: белковая молекула лежит "змейкой", удаленные отрезки цепи оказываются поблизости друг от друга. В результате пептидные группы ранее удаленных аминокислот белковой цепи способны взаимодействовать при помощи водородных связей.
Ориентация реагирующих участков может быть параллельна (когда соседние цепи идут в одном направлении) или антипараллельна (цепи идут в противоположном направлении). Таких взаимодействующих друг с другом участков одного белка может быть от двух до пяти. Под направлением белковой цепи понимают направление от N-конца (N-концевой аминокислоты) к C-концу (С-концевой аминокислоте).
Также существуют нерегулярные вторичные структуры, аминокислотные остатки которых имеют разную конформацию главной цепи:
· повороты — нерегулярные участки полипептидной цепи, которые обеспечивают поворот её направления на 180°. Если участок, обеспечивающий поворот, достаточно длинный, используется термин петля; Венкатачалам ввёл для них термин β-изгиб. Также существуют повороты из 4, 5 и 6 аминокислотных остатков.
· полуповороты, или переходы, — нерегулярные участки полипептидной цепи, которые обеспечивают поворот её направления на 90°. Минимальный полуповорот состоит из 3 аминокислотных остатков.
Дата добавления: 2020-11-18; просмотров: 700;











