Энергия Ван-дер-Ваальсова взаимодействия: взаимодействие сил отталкивания и притяжения в белках, формула Леннард-Джонса.
Ван-дер-Ваальсова взаимодействия, обусловливают притяжение между молекулами. Они включают в себя три составляющие: диполь-дипольное, индукционное и дисперсионное взаимодействия.
На малых расстояниях начинают сказываться силы отталкивания между атомами, которые связаны с эффектами отталкивания электронных облаков при их взаимопроникновении.
Значение энергии притяжения обратно пропорционально r6: (1/r)6 Значение энергии отталкивания обратно пропорционально r12: (1/r)12.
Потенциалы взаимодействия складываются из энергии притяжения и отталкивания. их, как правило, не рассчитывают строго теоретически, а задают в виде атом-атомных потенциалов Букингема или Леппарда-Джонса. Формула Леннард-Джонса:
ULD = E0[(r0/r)12 — (r0/r)6] или ULD = А/ r12 - В/ r6
где А и В — эмпирические константы
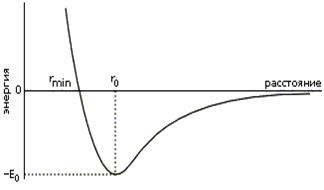
Минимум на кривой при г = r0 соответствует равновесному положению, в котором силы притяжения уравновешиваются силами отталкивания.
Формула при заданных значениях констант определяет минимальное расстояние, на котором система из двух взаимодействующих атомов устойчива. Если ограничиться только силами Ван-дер-Ваальса, не принимая во внимание других взаимодействий, то силовое поле вокруг атома обладает центром симметрии. Тогда можно определить тот эффективный объем вокруг атома, или эффективный радиус взаимодействия, в пределах которого невозможно одновременное нахождение двух атомов.
Г. Рамачандран (1963) нашел минимальные расстояния для пар различных атомов и небольших атомных групп (СНз,СН2). Например, для пары ковалентно не связанных атомов С • • • С обычное расстояние составляет 0,32 нм а минимально возможное — 0,3нм.
Использование этих расстояний полезно при составлении стерических карт биополимеров, так как позволяет определить стерически разрешенные области взаимного расположения атомных групп. Однако недостатком данного подхода явилось предположение о центрально-симметричной картине взаимодействия и пренебрежение направленным характером сил.
Характерные параметры потенциалов Ван-дер-Ваальсовых взаимодействий
| Взаимодействие | E0, ккал/моль | r0, Å | rmin, Å |
| H . . . . H | 0.12 | 2.4 | 2.0 |
| H . . . . C | 0.11 | 2.9 | 2.4 |
| C . . . . C | 0.12 | 3.4 | 3.0 |
| O . . . . O | 0.23 | 3.0 | 2.7 |
| N . . . . N | 0.20 | 3.1 |
Дата добавления: 2020-11-18; просмотров: 1102;











