Элементарные взаимодействия в белках: водородные связи, их характеристика.
Элементарные взаимодействия в белках делятся на: Ковалентные связи, Координационные связи, Силы Ван-дер-Ваальса, Водородные связи и Гидрофобные взаимодействия.
Вода — Н2О — кипит при 3730К, а твердеет при 2730К, в то время как О2 кипит при 900К и твердеет при 540К; Н2 кипит при всего 200К и плавится при 40К.
То, что структуры воды и льда с трудом разрушаются теплом, показывает, что молекулы воды чем-то очень сильно связаны между собой.
Водородные связи. Образуются между атомом водорода, ковалентно связанным с электроотрицательным атомом и другим электроотрицательным атомом(О, N, F, Сl). Но С-H группа, например, водородных связей не образует: атом С — недостаточно электроотрицательный атом. Водородная связь имеет электростатическую природу и связана с наличием парциальных зарядов на взаимодействующих атомах. Водородная связь направлена от донора(водород) к акцептору(атому O или N). Водород всегда выступает донором одной водородной связи, кислород может быть акцептором двух водородных связей.
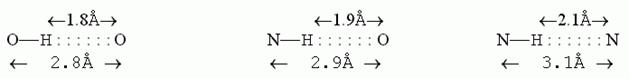
Заряды на полярных атомах появляются в результате того, что электроотрицательные атомы O оттягивают электронные облака от соседних Н атомов. В результате на последних возникают небольшие положительные заряды, а на O — отрицательный заряд.
В белках водородные связи образуются между отдельными группами аминокислотных остатков и между полярными АК и молекулами воды. Водородные связи стабилизируют вторичную структуру полипептидных цепей.
Парциальные заряды молекулы воды взаимодействуют с энергией порядка 10 ккал/моль на расстоянии 3, чего хватает на то, чтобы, при притяжении Н к О, "промять" электронные оболочки атомов.
Особенно этот эффект "проминания" облаков существенен для атомов водорода: здесь электронная оболочка Н, и так состоявшая всего из одного электрона, оттянута к О атому, так что смять ее особенно легко. Смять электронную оболочку, скажем, О атома много труднее — вокруг ядра О вращается 8 "своих" электронов, да еще какую-то часть электронного облака атом О (в Н2О) оттягивает у соседних водородов.
Легкость проминания электронного облака у Н атома и превращает обычное электростатическое взаимодействие в водородную связь.
Дата добавления: 2020-11-18; просмотров: 847;











