Третичная структура белка, характеристика. Четвертичная структура белка, характеристика, отличия от агрегатов.
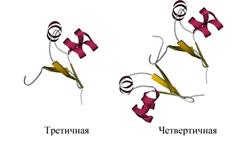
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой.
Третичная структура белка формируется совершенно автоматически, самопроизвольно и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры, является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот группируются внутри белковой молекулы, в то время как полярные радикалы ориентируются в сторону воды. В какой-то момент возникает термодинамически наиболее выгодная стабильная конформация молекулы – глобула. В такой форме белковая молекула характеризуется минимальной свободной энергией. На конформацию возникшей глобулы оказывают влияние такие факторы как рН раствора, ионная сила раствора, а также взаимодействие белковых молекул с другими веществами. Стабилизация третичной структуры обеспечивается благодаря нековалентным взаимодействиям между атомными группировками боковых радикалов следующих типов:
- водородные связи могут возникать между функциональными группами боковых радикалов. Например, между ОН группой тирозина и –N<в кольце остатка гистидина.
- электростатические силы притяжения между радикалами, несущими противоположно заряженные ионные группы (ион-ионные взаимодействия), например отрицательно заряженная карбоксильная группа
(– СОО– ) аспарагиновой кислоты и (NН3+) положительно заряженной e-аминогруппой остатка лизина.
- гидрофобные взаимодействия обусловлены силами Ван-дер-Ваальса между неполярными радикалами аминокислот. (Например, группами
–СН3 – аланина.
- ковалентной дисульфидной связью (–S–S–) между остатками цистеина. Эта связь очень прочная и присутствует не во всех белках.
Только после приобретения белковой молекулой естественной, нативной третичной структуры он проявляет свою специфическую функциональную активность: каталитическую, гормональную, антигенную и т.д. Именно при образовании третичной структуры происходит формирование активных центров ферментов, центров ответственных за встраивание белка в мультиферментный комплекс, центров, ответственных за самосборку надмолекуляных структур. Поэтому любые воздействия (термические, физические, механические, химические), приводящие к разрушению этой нативной конформации белка (разрыв связей), сопровождается частичной или полной потерей белком его биологических свойств.
По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена).
Некоторые белковые макромолекулы могут соединяться друг с другом и образовывать относительно крупные агрегаты. Подобные полимерные образования белков, где мономерами являются макромолекулы белка, называются четвертичными структурами. Такой белок с четвертичной структурой называется олигомером, а его полипептидные цепи с третичной структурой — протомерами или субъединицами .
При четвертичном уровне организации белки сохраняют основную конфигурацию третичной структуры (глобулярную или фибриллярную). Например, гемоглобин - белок, имеющий четвертичную структуру, состоит из четырех субъединиц, которые образуют единый макромолекулярный агрегат. Каждая из субъединиц — глобулярный белок и в целом гемоглобин тоже имеет глобулярную конфигурацию.
Стабилизация четвертичной структуры белков:
Контакты между поверхностями субъединиц возможны только за счет полярных групп аминокислотных остатков, поскольку при формировании третичной структуры каждой из полипептидных цепей боковые радикалы неполярных аминокислот (составляющих большую часть всех протеиногенных аминокислот) спрятаны внутри субъединицы. Между их полярными группами образуются многочисленные ионные (солевые), водородные, а в некоторых случаях и дисульфидные связи, которые прочно удерживают субъединицы в виде организованного комплекса.
Дата добавления: 2020-11-18; просмотров: 634;











