Силы Ван-дер-Ваальса, характеристика, примеры на белковых молекулах.
Вандерваальсово взаимодействие (относится к слабым типам связей; межмолекулярные взаимодействия, не приводящие к образованию хим. соединений):
· Ориентационные силы:
Энергия диполь-дипольного взаимодействия равна:
Wдд = - p12p22 / 6 πɛ0ɛkTr6 
где p1 иp2 - дипольные моменты взаимодействующих молекул;
r – расстояние между молекулами (диполями)
K – постоянная Больцмана;
T – температура;
ɛ0 - = 8,85* 10-12 Ф/м – электрическая постоянная
ɛ - относительная диэлектрическая проницаемость среды.
· Индукционное взаимодействие (наведенное):
Молекула, имеющая постонный дипольный момент, способна индуцировать его в соседней молекуле.
Энергия индукц. взаимодействия равна:Wинд= -αp2 / 2πε0εr6
где α - поляризуемость молекулы или атомной группы, p – дипольный момент
· Дисперсионные взаимодействия
Wдисп= - 2 I1I2 / 3 (I1+I2) * α1 α2 / r6
где I1 и I2 - потенциалы ионизации групп; α1 и α2 - поляризуемости групп.
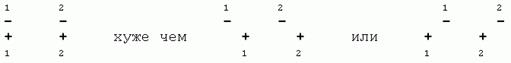
Электрическая энергия растет с уменьшением расстояния r как 1/r.
Согласованное колебание электронов (квантовый эффект) понижает энергию системы.
*Вандерваальсовым взаимодействием (в числе прочих слабых взаимодействий) обусловлены вторичная и более высокого уровня структуры белка, в частности, четвертичная структура: объединение нескольких пептидных цепей в комплекс – примеры: гемоглобин, многие ферменты (фосфорилаза – отв. за перенос и деградацию гликогена в клетках).Наличие четвертичной структуру ферментных белков важно для их физиологической активности.
(*-не по лекциям)
Дата добавления: 2020-11-18; просмотров: 551;











