Вычисление растворимости электролита (S) в моль/л
| Тип электролита | Растворимость, моль/л |
| 1. Бинарный электролит (типа BaSO4, CaCO3 и др.) | 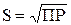
|
| 2. Трехионный электролит (типа CaF2, Ag2CrO4 и др.) | 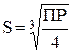
|
| 3. Четырехионный электролит (типа Ag3PO4, BiJ3 и др.) | 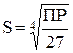
|
| 4. Пятиионный электролит (типа Ca3(PO4)2,Bi2 J3 др.) | 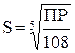
|
Таблица 6
Плотности водных растворов некоторых кислот и щелочей
при 15 0С (в г/см3)
| W, % | Вещество | ||||
| H2SO4 | HNO3 | HCl | KOH | NaOH | |
| 1,013 | 1,011 | 1,009 | 1,016 | 1,023 | |
| 1,027 | 1,022 | 1,019 | 1,033 | 1,046 | |
| 1,040 | 1,033 | 1,029 | 1,048 | 1,069 | |
| 1,055 | 1,044 | 1,039 | 1,065 | 1,092 | |
| 1,069 | 1,056 | 1,049 | 1,082 | 1,115 | |
| 1,083 | 1,068 | 1,059 | 1,100 | 1,137 | |
| 1,098 | 1,080 | 1,069 | 1,118 | 1,159 | |
| 1,112 | 1,093 | 1,079 | 1,137 | 1,181 | |
| 1,127 | 1,106 | 1,083 | 1,156 | 1,213 | |
| 1,143 | 1,119 | 1,100 | 1,176 | 1,225 | |
| 1,158 | 1,132 | 1,110 | 1,196 | 1,247 | |
| 1,174 | 1,145 | 1,121 | 1,217 | 1,268 | |
| 1,190 | 1,158 | 1,132 | 1,240 | 1,289 | |
| 1,205 | 1,171 | 1,142 | 1,263 | 1,310 | |
| 1,224 | 1,184 | 1,152 | 1,286 | 1,332 | |
| 1,238 | 1,198 | 1,163 | 1,310 | 1,352 | |
| 1,255 | 1,211 | 1,173 | 1,334 | 1,374 | |
| 1,273 | 1,225 | 1,183 | 1,358 | 1,395 | |
| 1,290 | 1,238 | 1,194 | 1,384 | 1,416 | |
| 1,307 | 1,251 | 1,411 | 1,437 | ||
| 1,324 | 1,264 | 1,437 | 1,458 | ||
| 1,342 | 1,277 | 1,460 | 1,478 | ||
| 1,361 | 1,290 | 1,485 | 1,499 | ||
| 1,380 | 1,303 | 1,511 | 1,519 | ||
| 1,399 | 1,316 | 1,538 | 1,540 | ||
| 1,419 | 1,328 | 1,564 | 1,560 | ||
| 1,439 | 1,340 | 1,590 | 1,580 | ||
| 1,460 | 1,351 | 1,616 | 1,601 | ||
| 1,482 | 1,362 | 1,622 | |||
| Продолжение таблицы 6 | |||||
| W, % | Вещество | ||||
| H2SO4 | HNO3 | HCl | KOH | NaOH | |
| 1,503 | 1,3773 | 1,643 | |||
| 1,525 | 1,384 | ||||
| 1,547 | 1,394 | ||||
| 1,571 | 1,403 | ||||
| 1,594 | 1,412 | ||||
| 1,617 | 1,421 | ||||
| 1,640 | 1,429 | ||||
| 1,664 | 1,437 | ||||
| 1,687 | 1,445 | ||||
| 1,710 | 1,53 | ||||
| 1,732 | 1,460 | ||||
| 1,755 | 1,467 | ||||
| 1,776 | 1,474 | ||||
| 1,808 | 1,486 | ||||
| 1,819 | 1,491 | ||||
| 1,830 | 1,196 | ||||
| 1,837 | 1,500 | ||||
| 1,841 | 1,510 | ||||
| 1,838 | 1,522 |
Таблица 7
Криоскопические (К) и эбуллиоскопические (Е) постоянные
| Растворитель | Температура кристаллизации,0С | К | Температура кипения,0С | Е |
| Ацетон | – 94,6 | 2,4 | 56,0 | 1,48 |
| Анилин | –6 | 5,87 | 184,4 | 3,69 |
| Бензол | 5,5 | 5,10 | 80,2 | 2,57 |
| Вода | 1,86 | 0,52 | ||
| Камфора | 6,09 | 40,0 | 6,09 | |
| Нитробензол | 5,27 | 6,90 | 210,9 | 5,27 |
| Уксусная кислота | 16,7 | 3,90 | 118,4 | 3,1 |
| Фенол | 3,6 | 7,3 | 182,1 | 3,6 |
| Хлороформ | 3,88 | 4,9 | 61,2 | 3,88 |
| Четыреххлористый углерод | 4,3 | 2,98 | 76,7 | 5,3 |
Таблица 8
Полуреакции и стандартные окислительные потенциалы восстановления окислителей в водных растворах по отношению к водородному электроду
(при t = 25оС)
| Уравнение реакции | φ° | |
| АЗОТ HNO2 + e + H+ ↔ NO + H2O 2HNO2 + 6e + 6H+ ↔ N2 + 4H2O NO3- + 2e + 3H+ ↔ HNO2 + H2O NO3- + e + 2H+ ↔ NO2 + H2O NO3- + 3e + 4H+ ↔ NO + 2H2O NO3- + 8e + 10H+ ↔ NH4+ + 3H2O NO3- + 8e + 6H2O ↔ NH3 + 9OH- N2 + 6e + 8H+ ↔ 2NH4+ | +0,99 +1,45 +0,94 +0,81 +0,96 +0,87 -0,12 +0,28 | |
| АЛЮМИНИЙ Al3+ + 3e ↔ Al AlO2- + 3e + 2H2O ↔ Al + 4OH- | -1,67 -2,35 | |
| БАРИЙ Ba2+ + 2e ↔ Ba | -2,90 | |
| БЕРИЛЛИЙ Be2+ + 2e ↔ Be | -1,70 | |
| БОР HBO3 + 3e + 3H+ ↔ B + 3H2O | -0,74 | |
| БРОМ Br2 + 2e ↔ 2Br – HBrO + 2e + H+ ↔ Br - + H2O BrO- + 2e + H2O ↔ Br - + 2OH- 2BrO3- + 10e + 12H+ ↔ Br2 + 6H2O BrO3- + 6e + 6H+ ↔ Br - + 3H2O BrO3- + 6e + 3H2O ↔ Br - + 6OH- | +1,087 +1,35 +0,76 -1,52 +1,44 +0,60 | |
| ВАНАДИЙ V2+ + 2e ↔ V V3+ + e ↔ V2+ VO2+ + e + 2H+ ↔ V3+ + H2O VO2+ + e + 2H+ ↔ VO2+ + H2O VO2+ + 2e + 4H+ ↔ V3+ + 2H2O VO2+ + 3e + 4H+ ↔ V2+ + 2H2O | -1,5 -0,2 +0,314 -1,0 +0,657 +0,37 | |
| ВИСМУТ Bi3+ + 3e ↔ Bi NaBiO3 + 2e + 6H+ ↔ Bi3+ + Na+ + 3H2O | +0,215 +1,8 | |
| ВОДОРОД 2H+ + 2e ↔ H2 H2 + 2e ↔ 2H- 2H2O + 2e ↔ H2 + 2OH- | 0,00 -2,33 -0,828 | |
| ВОЛЬФРАМ WO2 + 4e + 4H+ ↔ W + 2H2O WO3 + 6e + 6H+ ↔ W + 3H2O WO4 2- + 6e + 4H2O ↔ W + 8OH- | -0,05 -0,09 -1,1 | |
| ГЕРМАНИЙ H2GeO3 + 4e + 4H+ ↔ Ge + 3H2O | -0,13 | |
| ЖЕЛЕЗО Fe2+ + 2e ↔ Fe Fe3+ + e ↔ Fe2+ [Fe(CN)6]2- + e ↔ [Fe(CN)6]- [FeF6]3- + e ↔ Fe2+ + 6F- Fe(OH)3 + e ↔ Fe(OH)2 + OH- | -0,44 +0,771 +0,36 +0,40 -0,56 | |
| ЗОЛОТО Au3+ + e ↔ Au2+ [AuCl4] - + 3e ↔ Au + 4Cl- Au3+ + 2e ↔ Au+ Au+ + e ↔ Au [Au(CN)2] - + e ↔ Au + 2CN- | +1,42 +1,00 +1,29 +1,68 -0,6 | |
| ИОД I2 + 2e ↔ 2I – [I3]- + 2e ↔ 3I - 2HIO + 2e + 2H+ ↔ I2 + 2H2O IO- + 2e + H2O ↔ I - + 2OH- 2IO3- + 10e + 12H+ ↔ I2 + 6H2O IO3- + 6e + 6H+ ↔ I - + 3H2O IO3- + 6e + 3H2O ↔ I - + 6OH- H5IO6 + 2e + H+ ↔ IO3 - + 3H2O | +,534 +0,535 +1,45 +0,49 +1,19 +1,085 +0,26 +1,60 | |
| КАЛИЙ K+ + e ↔ K | -2,92 | |
| КАЛЬЦИЙ Ca2+ + 2e ↔ Ca | -2,87 | |
| КИСЛОРОД O2 + 4e + 4H+ ↔ 2H2O O2 + 4e + 2H2O ↔ 4OH- O3 + 2e + 2H+ ↔ O2 + H2O O3 + 2e + 2H2O ↔ O2 + 2OH- O2 + 2e + 2H2O ↔ H2O2 + 2OH- H2O2 + 2e + 2H+ ↔ 2 H2O O2 + 2e + 2H+ ↔ H2O2 | +1,23 +0,401 +2,07 +1,24 -0,076 +1,77 +0,682 | |
| КОБАЛЬТ Co2+ + 2e ↔ Co Co3+ + e ↔ Co2+ Co(OH)3 + e ↔ Co(OH)2 + OH- [Co(NH3)6]3+ + e ↔ [Co(NH3)6]2+ [Co(CN)6]3- + e ↔ [Co(CN)6]2- | -0,277 +1,842 +0,2 +0,1 -0,83 | |
| КРЕМНИЙ Si + 4e + 4H+ ↔ SiH4 Si + 4e + 4H2O ↔ SiH4 + 4OH- SiO2 + 4e + 4H+ ↔ Si + 2H2O SiO32- + 4e + 3H2O ↔ Si + 6OH- [SiF6]2- + 4e ↔ Si + 6F- | +0,04 -0,79 -0,6 -1,73 -1,17 | |
| ЛИТИЙ Li+ + e ↔ Li | -3,02 | |
| МАГНИЙ Mg2+ + 2e ↔ Mg | -2,34 | |
| МАРГАНЕЦ Mn2+ + 2e ↔ Mn MnO2 + 2e + 4H+ ↔ Mn2+ + 2H2O MnO4- + 5e + 8H+ ↔ Mn 2++ 4H2O MnO4- + 3e + 4H+ ↔ MnO2 + 2H2O MnO4- + 2e + 2H2O ↔ MnO2 + 4OH- MnO4- + 3e + 2H2O ↔ MnO2 + 4OH- | -1,05 +1,28 +1,62 +1,67 +0,58 +0,57 | |
| МЕДЬ Cu2+ + 2e ↔ Cu Cu2+ + e ↔ Cu+ Cu2+ + e + I- ↔ CuI Cu2+ + e + 2CN- ↔ [Cu(CN)2]- | +0,345 +0,167 +0,88 +1,12 | |
| МЫШЬЯК AsO2- + 3e + 2H2O ↔ As + 4OH- HAsO2 + 3e + 3H+ ↔ As + 2H2O H3AsO4 + 2e + 2H+ ↔ HAsO2 + 2H2O AsO43- + 2e + 2H2O ↔ AsO2- + 4OH- As + 3e + 3H+ ↔ AsH3 | -0,68 +0,247 +0,559 -0,71 -0,54 | |
| НАТРИЙ Na+ + e ↔ Na | -2,712 | |
| НИКЕЛЬ Ni2+ + 2e ↔ Ni Ni(OH)3 + e ↔ Ni(OH)2 + OH- Ni(OH)3 + e + 3H+ ↔ Ni(OH)2 + OH- [Ni(CN)4]3- + e ↔ [Ni(CN)6]2- | -0,25 +0,49 +1,75 +0,82 | |
| ОЛОВО Sn2+ + 2e ↔ Sn Sn4+ + 2e ↔ Sn2+ Sn4+ + 4e ↔ Sn HSnO2- + 2e + H2O ↔ Sn + 3OH- [Sn(OH)6]2- + 2e ↔ HSnO2- + 3OH- + H2O | -0,136 +0,15 +0,01 -0,79 -0,96 | |
| ОСМИЙ OsO4 + 8e + 8H+ ↔ Os + 4H2O | +0,83 | |
| ПЛАТИНА [PtCl4]2- + 2e ↔Pt + 4Cl- [PtCl6]2- + 2e ↔ [PtCl4]2- +2Cl- | +0,73 +0,72 | |
| РТУТЬ Hg2+ + 2e ↔ Hg Hg 22+ + 2e ↔ 2Hg 2Hg2+ + 2e ↔ Hg22+ 2HgCl2 + 2e ↔ Hg2Cl2 +2Cl- Hg2Cl2 + 2e ↔ 2Hg +2Cl- | +0,854 +0,799 +0,910 +0,62 +0,268 | |
| СВИНЕЦ Pb2+ + 2e ↔ Pb Pb4+ + 2e ↔ Pb2+ Pb4+ + 4e ↔ Pb PbO2 + 2e + 4H+ ↔ Pb2+ + 2H2O | -0,126 +1,69 +0,78 +1,456 | |
| СЕРА S + 2e ↔ S2- S + 2e + 2H+ ↔ H2S [S2]2- + 2e + 2H+ ↔ 2S2- S4O62- + 2e ↔ 2S2O32- SO32- + 6e + 3H2O ↔ S2- + 6OH- SO42- + 2e + 4H+ ↔ H2SO3 + H2O SO42- + 2e + H2O ↔ SO32- + 2OH- SO42- + 6e + 6H+ ↔ S + 4H2O S2O82- + 2e ↔ 2SO42- (SCN)2 + 2e ↔ 2SCN- SO42- + 8e + 8H+ ↔ S2- + 4H2O SO42- + 8e + 10H+ ↔ H2S + 4H2O | -0,508 +0,141 -0,51 +0,15 -0,61 _0,20 -0,90 +0,37 +2,05 +0,77 -0,149 -0,311 | |
| СЕЛЕН Se + 2e ↔ Se2- | -0,78 | |
| Se + 2e + 2H+ ↔ H2Se SeO42- + 2e + H2O ↔ SeO32- + 2OH- | -0,36 +0,03 | |
| СЕРЕБРО Ag+ + e ↔ Ag Ag2O + 2e + H2O ↔ 2Ag + 2OH- Ag2S + 2e ↔ 2Ag + S2- [Ag(CN)2]- + e ↔ Ag + 2CN- AgCl + e ↔ Ag + Cl- AgBr + e ↔ Ag + Br- AgI + e ↔ Ag + I- | +0,799 +0,344 -0,71 -0,29 +0,222 +0,073 -0,151 | |
| СУРЬМА Sb + 3e + 3H+ ↔ SbH3 SbO- + 3e + 2H+ ↔ Sb + H2O SbO3- + 2e + H2O ↔ SbO2- + 2OH- | -0,51 +0,212 -0,59 | |
| ТАЛЛИЙ Tl+ + e ↔ Tl Tl3+ + 2e ↔ Tl+ Tl3+ + 3e ↔ Tl | -0,336 +1,25 +0,72 | |
| ТЕЛЛУР Te + 2e ↔ Te2- Te + 2e + 2H+ ↔ H2Te TeO42- + 2e + H2O ↔ TeO32- + 2OH- | -0,92 -0,69 +0,4 | |
| ТИТАН Ti2+ + 2e ↔ Ti Ti3+ + e ↔ Ti2+ TiO2 + 4e + 4H+ ↔ Ti + 2H2O [TiF6]2- + 4e ↔ Ti + 6F- | -1,75 -0,37 -0,85 -1,24 | |
| УГЛЕРОД CH3CHO + 2e + 2H+ ↔ C2H5OH HCHO + 2e + 2H+ ↔ CH3OH HCOOH + 2e + 2H+ ↔ HCHO + H2O CO2 + 2e + 2H+ ↔ HCOOH CH3COOH + 2e + 2H+ ↔ CH3CHO + H2O 2CO2 + 2e + 2H+ ↔ HOOCCOOH C6H4O2 + 2e + 2H+ ↔ C6H4(OH)2 | +0,18 +0,24 -0,01 -0,14 +0,31 -0,49 +0,699 | |
| ФТОР F2 + 2e ↔ 2F – | +2,85 | |
| F2 + 2e + 2H+ ↔ 2HF OF2 + 4e + 2H+ ↔ 2F- + H2O | +3,03 +2,1 | |
| ХЛОР Cl2 + 2e ↔ 2Cl – ClO3- + 6e + 6H+ ↔ Cl- + 3H2O ClO3- + 6e + 3H2O ↔ Cl - + 6OH- HOCl + 2e + H+ ↔ Cl - + H2O ClO- + 2e + H2O ↔ Cl - + 2OH- ClO2 + 5e + 4H+ ↔ Cl- + 2H2O ClO4- + 8e + 8H+ ↔ Cl- + 4H2O ClO4- + 8e + 4H2O ↔ Cl - + 8OH- 2ClO3- + 10e + 12H+ ↔ Cl2 + 6H2O 2HOCl + 2e + 2H+ ↔ Cl2 + 2H2O | +1,358 +1,45 +0,62 +1,50 +0,94 +1,50 +1,34 +0,51 +1,47 +1,63 | |
| ХРОМ Cr2+ + 2e ↔ Cr Cr3+ + 3e ↔ Cr Cr3+ + e ↔ Cr2+ CrO42- + 3e + 4H2O ↔ Cr(OH)3 + 5OH- Cr2O72- + 6e + 14H+ ↔ 2Cr3+ + 7H2O | -0,8 -0,71 -0,41 -0,12 +1,36 | |
| ЦЕРИЙ Ce3+ + 3e ↔ Ce Ce3+ + e ↔ Ce2+ | +2,483 +1,44 | |
| ЦИНК Zn2+ + 2e ↔ Zn [Zn(CN)4]2- + 2e ↔ Zn + 4CN- ZnO22- + 2e + 2H2O ↔ Zn + 4OH- | -0,762 -1,26 -1,216 | |
| ЦИРКОНИЙ ZrO2 + 4e + 4H + ↔ Zr + 2H2O | -1,43 | |
Таблица
Латинский алфавит
| Шрифт ПЭВМ | Название | Шрифт ПЭВМ | Название | ||
| прямой | курсив | прямой | курсив | ||
| А а | А а | a | Nn | Nn | эн |
| В b | В b | бе | Оо | Оо | о |
| С с | С с | це | Рр | РР | пэ |
| D d | D d | де | Q q | Q q | ку |
| Е е | Е е | е | R r | R r | эр |
| F f | F f | эф | S s | S s | эс |
| G g | G g | ге | T t | T t | тэ |
| H h | H h | аш | U u | U u | у |
| I i | I i | и | V v | V v | ве |
| J j | J j | йот | W w | W w | дубль-ве |
| K k | K k | ка | X x | X x | икс |
| L I | L l | эль | Y y | Y y | игрек |
| M m | M m | эм | Z z | Z z | зет |
Таблица
Греческий алфавит
| Шрифт ПЭВМ | Название | Произношение | Латинская транскрипция |
| Aa | альфа | а | а |
| Bb | бета | б | b |
| Gg | гамма | г | g |
| Dd | дельта | д | d |
| Ee | эпсилон | э | е |
| Zz | дзэта | дэ | z |
| Hh | эта | э | 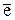
|
| QqJ | тхэта | тх | th |
| Ii | йота | и | i |
| Kk | каппа | к | с |
| Ll | ламбда | л | |
| Mm | мю | м | m |
| Nn | ню | н | n |
| Xx | кси | кс | x |
| Oo | омикрон | о | o |
| Pp | ли | п | p |
| Rr | Ро | р | r |
| SsV | сигма | с | s |
| Tt | тау | т | t |
| Uu | ипсилон | ю | у |
| Ffj | фи | ф | ph |
| Cc | хи | х | ch |
| Yy | пси | пс | ps |
| Ww | омега | о | 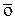
|
Таблица
Дата добавления: 2020-11-18; просмотров: 635;











