П Р И Л О Ж Е Н И Е
Добавить таблицу названия кислот и кислотных остатков
Таблицу с возможными степенями окисления.
Таблицу с правилами расстановки степени окисления.
Словарь с названиями
Таблица 1
Константы нестойкости некоторых комплексных ионов
| Уравнение диссоциации комплексного иона | Константа нестойкости (Кн) |
| [Ag(CN)2]- = Ag+ + 2CN– | 1,0 × 10– 21 |
| [Ag(NH3)2]+ = Ag+ + 2NH3 | 5,89 × 10–8 |
| [AgBr2]– = Ag+ + 2Br– | 7,8 × 10–8 |
| [AgCl2]– = Ag+ + 2Cl– | 1,78 × 10–5 |
[Ag(S2O3)2]3– = Ag+ + 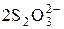
| 1,0 × 10–18 |
| [AlF6]3- = Al3+ + 6F– | 5,01 × 10–18 |
| [Cd(CN)4]– = Cd2+ + 4CN– | 7,66 × 10–18 |
| [CdI4]2– = Cd2+ + 4I– | 7,94 × 10–7 |
| [Cd(NH3)4]2+ = Cd2+ + 4NH3 | 2,75 × 10– 7 |
| [Co(CN)4]2– = Co2++ 4CN– | 5,50 × 10– 3 |
| [Со(NH3)6]2+ = Co2+ + 6NH3 | 4,07 × 10–5 |
| [Сu(CN)2]+ = Сu+ + 2CN– | 1,0 × 10–24 |
| [Cu(NH3)4]2+ = Cu2+ + 4NH3 | 9,33 × 10–13 |
| [Fe(CN)6]4– = Fe2+ + 6CN– | 1,0 × 10–24 |
| [Fe(CN)6]3– = Fe 3+ + 6CN– | 1,0 × 10– 31 |
| [HgCI4]2– = Hg2+ + 4CI– | 6,03 × 10–16 |
| [HgI4]2– = Hg2+ + 4I– | 1,38 × 10– 30 |
| [Hg(CN)4]2– = Hg2+ + 4CN– | 1,29 × 10–22 |
| [Ni(CN)4]2– = Ni2+ +4CN– | 1,0 × 10– 22 |
| [Ni(NH3)6]2+ = Ni2+ + 6NH3 | 9,77 × 10–9 |
[PbBr4]2– = Pb2+ + 4 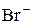
| 1,0 × 10– 3 |
| [PbI4]2– = Pb2+ + 4I– | 2,22 × 10–5 |
| [Zn(NH3)4]2+ = Zn2+ + 4NH3 | 3,46 × 10–10 |
| [Zn(CN)4]2– = Zn2+ + 4CN– | 1 × 10–16 |
| [Zn(CNS)4]2– = Zn2+ + 4CNS– | 5,0 × 10–2 |
| [Zn(OH)4]2– = Zn2+ + 4OH– | 7,08 × 10–16 |
Таблица 2
Константы диссоциации (Кд) слабых электролитов
| Название | Формула | Кд |
| Кислоты | ||
| Азотистая | HNO2 | 6,9 × 10–4 |
| Борная (орто): | ||
| K1 | Н3BO3 | 7,1 × 10–10 |
| K2 | 1,8 × 10–13 | |
| K3 | 1,6 × 10–14 | |
| Борная (тетра): | ||
| K1 | Н2В4O7 | 1,8 × 10–4 |
| K2 | 2,0 × 10–8 | |
| Бромноватая | HBrO3 | 2,0 × 10–1 |
| Бромноватистая | HBrO | 2,2 × 10–9 |
| Гидросернистая (дитионистая) K1 | H2S2O4 | 5,0 × 10–1 |
| K2 | 3,2 × 10–3 | |
| Дихромовая K2 | H2Cr2O7 | 2,3 × 10–2 |
| Иодноватая | HIO3 | 1,7 × 10–1 |
| Иодноватистая | HIO | 2,3 × 10–11 |
| Марганцовистая K1 | H2MnO4 | 10–1 |
| K2 | 7,1 × 10–1 | |
| Муравьиная | HCOOH | 1,8 × 10–4 |
| Мышьяковистая | H3AsO3 | 5,9 × 10–10 |
| Пероксид водорода | H2O2 | 2,6× 10–12 |
| Роданистоводородная | HSCN | 1,4 · 10-1 |
| Серная K2 | H2SO4 | 1,15 × 10–2 |
| Сернистая K2 | H2SO3 | 1,4 × 10–2 |
| K2 | 6,2 × 10–8 | |
| Сероводородная K1 | H2S | 1,0 × 10–7 |
| K2 | 2,5 × 10–13 | |
| Синильная | HCN | 5,0 × 10–10 |
| Тиосерная K1 | H2S2O3 | 2,5 × 10–1 |
| K2 | 1,9 × 10–2 | |
| Трихлоруксусная | CCI3COOH | 2,1 × 10–1 |
| Угольная K1 | CO2+H2O | 4,5 × 10–7 |
| K2 | 4,8 × 10–11 | |
| Уксусная | CH3COOH | 1,74× 10–5 |
| Фосфористая K1 | H3PO3 | 3,1× 10–2 |
| K2 | 1,6 × 10–7 | |
| Фосфорная (орто) K1 | H3PO4 | 7,1 × 10–3 |
| K2 | 6,2 × 10–8 | |
| K3 | 5,0 × 10–13 | |
| Фосфористоводородная | HF | 6,2 × 10–4 |
| Хлористая | HCIO2 | 1,1 × 10–2 |
| Хлорноватистая | HСlO | 2,95 × 10–8 |
| Хлорноуксусная | CH2CICOOH | 1,4 × 10–3 |
| Хромовая K1 | Н2CrO4 | 1,6 × 10–1 |
| K2 | 3,2 × 10–7 | |
| Продолжение таблицы 2 | ||
| Название | Формула | Кд |
| Щавелевая K1 | Н2С2O4 | 5,6 × 10–2 |
| Основания | ||
| Аммиака раствор | NH3 + H2O | 1,76 × 10–5 |
| Бария гидроокись K2 | Ba(OH)2 | 2,3 × 10–1 |
| Кальция гидроксид K2 | Ca(OH)2 | 4,0 × 10–2 |
| Свинца гидроксид (II) K1 | Pb(OH)2 | 9,55 × 10–4 |
| K2 | 3,0 × 10–8 | |
| Марганца гидроксид (II) | Mn(OH)2 | 5,0 × 10–4 |
| Никеля гидроксид | Ni(OH)2 | 2,5 × 10–5 |
| Цинка гидроксид | Zn(OH)2 | 4,0 × 10–5 |
| Железа гидроксид (III) | Fe(OH)3 | 1,82 × 10–10 |
| Меди гидроксид | Cu(OH)2 | 3,4 × 10–7 |
Таблица 3
Дата добавления: 2020-11-18; просмотров: 528;











