Обнаружение аниона соли дробным методом
При анализе анионов сначала определяют группу, к которой относится искомый анион. Для этого применяют групповые реагенты ВаСl2 и AgNО3.
Установив группу, обнаруживают анион, используя для этого характерные реакции.
1. Обнаружение анионов I группы. К 1-2 мл анализируемого раствора добавить 1-2 мл раствора хлорида бария ВаСl2. Если выпадает осадок, то к нему прилить 2-3 мл 2н раствора соляной кислоты НСl.
- если осадок в кислоте не растворяется, значит, в растворе находятся ионы SO42-,
- если осадок в кислоте растворяется с выделением газа, значит, в растворе находятся ионы CO32-,
- если осадок в кислоте растворяется без выделения газа, значит, в растворе находятся ионы PO43-.
2. Обнаружение анионов II группы. К 1-2 мл анализируемого раствора прилить несколько капель HNO3 (1:1) и несколько капель раствора AgNО3 – образуется осадок. Надосадочную жидкость слить и прилить избыток раствора NH4OH.
- если осадок растворяется в избытке NH4OH, значит, в растворе присутствуют ионы Cl-,
- если осадок не растворяется в избытке NH4OH, значит, в растворе присутствуют ионы Br– или J–:
для обнаружения J- к анализируемом растворуприлить немного 2н раствора Н2SO4, 0,5-1 мл бензола C6H6 и столько же хлорной воды (CI2), смесь перемешать стеклянной палочкой: если бензольный слой окрашивается в фиолетовый цвет, в растворе присутствуют ионы J–.
3. Обнаружение NO3 – (аниона III группы). К 1-2 мл анализируемого раствора прилить столько же раствора FeSO4 и затем осторожно по стенке пробирки, избегая перемешивания жидкостей, концентрированной серной кислоты H2SO4. Если на границе жидкостей образуется бурое кольцо комплексной соли [Fe(NO)]SO4, следовательно, в составе исследуемой соли находится анион азотной кислоты NO 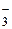 -.
-.
Выполнив анализ, делают вывод о составе соли и пишут ее формулу.
Запись в лабораторном журнале рекомендуется оформлять в виде таблицы 5.2, первые три графы которой уже заполнены.
2. Испытание на присутствие Mg2+ -ионов.
· К охлаждённому остатку добавить 1-2 мл дистиллированной воды
· Разделить на четыре пробирки полученный раствор
· В пробирку №1 прибавить несколько капель 2 н. р-ра КОН или NaOH
· Наблюдение: образуется белый специфический осадок – Mg(OH)2
· Осадок можно отделить фильтрованием
· Внести в пробирку № 2 несколько капель 2н. раствора уксусной кислоты
· Вывод: растворились основные соли магния
При действии карбоната аммония на смесь катионов 1-ой и 2-ой группы частично осаждается и ион первой группы Mg2+ в виде мало растворимой основной соли:
2MgCl2 + 2(NH4)2CO3 + H2O D (MgOH)2CO3 ↓ + 4NH4Cl + CO2↑
Во избежании этого к раствору добавляют хлорид аммония, в котором гидроксокарбонат магния растворяется и Mg2+ остается в растворе с первой группой.
Дата добавления: 2020-11-18; просмотров: 664;











