Применение в медицине
Медь относится к содержащимся в организме микроэлементам, играющим определенную роль в процессах метаболизма, поэтому в последнее время содержащими ее лекарственными средствами стали пользоваться для общего воздействия на организм. Меди сульфат включен в состав ряда комплексных поливитаминных средств – таблеток "Квадевит", "Глутамевит", "Олиговит", "Компливит" и др. Меди сульфат применяют иногда как антисептическое и вяжущее средство. Ранее меди сульфат назначали внутрь как рвотное средство.
Соли ртути ранее использовались как антисептическое средство. При лечении кожных заболеваний применялись лекарственные средства ртути дихлорида, ртути оксицианида, металлической ртути ("Мазь ртутная серная"), ртути амидохлорида.
Кобальт является стимулятором кроветворения, способствует усвоению организмом железа и усиливает процессы его преобразования (формирование белковых комплексов, синтез гемоглобина и др.), нормализует эритропоэтическую активность и устраняет анемию. Коамид (дихлорникотинамид-кобальт), например, применяют для лечения анемий, резистентных к лекарственным средсвам, содержащим железо.
.Действие группового реагента.
Групповым реагентом на VI группу катионов является раствор аммиака в присутствии пероксида водорода. В этом случае все ионы переменной степени окисления находятся в высшей степени окисления. Ионы VI группы при взаимодействии с водным раствором аммиака образуют осадки гидроксидов, растворимые в избытке реагента.
Большинство соединений катионов группы VI малорастворимы в воде. Нерастворимы в воде гидроксиды, сульфиды, карбонаты, фосфаты, гексацианоферраты и др. Растворимы в воде все хлориды, кроме хлорида меди (I), сульфаты, нитраты, ацетаты.
Водные растворы некоторых катионов VI группы имеют характерную окраску: соли кобальта — розового цвета, никеля — зеленого, меди — синего, растворимые соли кадмия и ртути бесцветны. Аммиачные комплексы также имеют характерную окраску.
Реакция с аммиаком. Водный раствор аммиака при взаимодействии с катионами VI группы в эквивалентных количествах образует осадки различного и зачастую переменного состава — гидроксиды, основные соли, аммиачные комплексы. При этом соединения меди и кобальта синие, никеля — зеленые, а кадмия и ртути бесцветные. Все эти осадки растворяются в избытке аммиака с образованием комплексных ионов [Co(NH3)6]2+ - желтый, [Ni(NH3)6]2+ - синеватый, [Cu(NH3)4]2+ (синий), [Mе(NH3)4]2+ (Mе = Cd, Hg, бесцветные).
Комплекс [CoII(NH3)6]2+ на воздухе под действием кислорода превращается в аммиачный комплекс кобальта (III).
Реакция с сильными основаниями. При взаимодействии растворов солей катионов VI группы с гидроксидами калия и натрия образуются гидроксиды, оксиды и основные соли. При осторожном добавлении гидроксида натрия к растворам солей никеля и кобальта выпадают основные соли CoCl(OH) синего цвета, NiCl(OH) зеленого цвета, при добавлении избытка щелочи при нагревании основные соли переходят в гидроксиды Co(OH)2 розового цвета и Ni(OH)2 зеленого цвета. Например, для кобальта:
CoCl2 + NaOH =CoCl(OH)↓ + NaCl
CoCl(OH) + NaOH =Co(OH)2↓ + NaCl
На воздухе розовый Co(OH)2 постепенно переходит в темно-бурый гидроксид кобальта (III) Co(OH)3:
4Co(OH)2 + O2 + 2H2O = Co(OH)3
В щелочных растворах в присутствии окислителей, например, пероксида водорода, окисление происходит мгновенно.
При взаимодействии солей ртути и меди с гидроксидами первоначально образуются голубой осадок гидроксида меди Cu(OH)2 и бесцветный осадок гидроксида ртути Hg(OH)2, которые при нагревании разлагаются с выделением черного оксида меди CuO и желтого оксида ртути HgO:
Hg(OH)2 → HgO + H2O
Cu(OH)2 → CuO + H2O
При действии гидроксидов натрия или калия на растворы солей кадмия образуется бесцветный осадок гидроксида кадмия Cd(OH)2.
Гидроксиды катионов VI группы растворимы в растворах сильных кислот и аммиака. Cu(OH)2 заметно растворим в растворах сильных щелочей с образованием купритов:
Cu(OH)2 + 2NaOH = Na2CuO2 + 2H2O
Реакция с сероводородом и растворимыми сульфидами.Катионы VI группы при взаимодействии с H2S или растворимыми сульфидами образуют осадки CoS, NiS, CuS, HgS черного цвета и CdS желтого цвета.
Реакция с гексацианоферратом (II) калия.K4[Fe(CN)6] образует со всеми катионами VI группы малорастворимые соединения общей формулы Ме2[Fe(CN)6]. Гексацианоферраты (II) никеля — желто-зеленого цвета, кобальта — серо-зеленого, меди — коричнево-красного, а кадмия и ртути — бесцветны.
Таблица 6.1
Схема систематического хода анализа катионов VI аналитической группы Cu2+, Hg2+, Co2+, Ni2+
| № этапа | Этапы исследования |
| 1. | Взаимодействие катионов VI аналитической группы с групповым реагентом (избыток NH3*H2O): Cu2+ изб.NH3*H2O [Cu(NH3O)4]2+ Hg2+ изб.NH3*H2O [Hg(NH3O)4]2+ Co2+ изб.NH3*H2O [Co(NH3O)6]2+ Ni2+ изб.NH3*H2O [Ni(NH3O)6]2+ |
| 2. | Разрушение аммиакатов действием 2 моль/дм3 H2SO4 |
| 3. | Отделение Cu2+ и Hg2+ ионов от других катионов VI аналитической группы действием Na2S2O3 на раствор №2: Cu2+ Na2S2O3;Δ Cu2S↓ + S↓ Hg2+ Na2S2O3;Δ HgS↓ |
| 4. | Отделение Cu2S от HgS при частичном растворении осадка №3 в разб. HNO3 при нагревании: Cu2S↓ HNO3;Δ Cu2+ |
| 5. | Определение Cu2+ ионов в растворе №4 действием концентрированного NH3 * H2O: Cu2+ NH3*H2O [Cu(NH3)4]2+ |
| 6. | Растворение осадка № 4 действием бромной воды в присутствии HCl или в «царской водке»: HgS↓ Br;HCl [HgCl2] + S↓ HgS↓ конц.HNO3,конц. HCl [HgCl2] |
| 7. | Отделение [HgCl2] от S↓ центрифугированием. |
| 8. | Определение Hg2+ ионов в центрифугате №7 действием раствора SnCl2: [HgCl2] SnCl2 Hg↓ |
| 9. | Определение Co2+ ионов в центрифугате №3 действием раствора NH4NCS в присутствии амилового спирта: Co2+ NH4NCS (NH4)2[Co(NCS)4] C5H11OH |
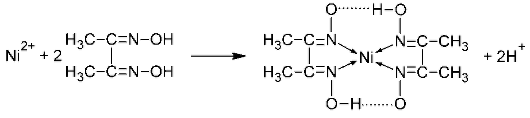
| 10. | Определение Ni2+ ионов в центрифугате №3 действием реактива Чугаева (диметилглиоксима):
|
Работа 6. Реакции катионов шестой группы
Цель: изучить характерные качественные реакции наиболее распространенных катионов VI группы Co2+, Ni2+, Cu2+, Cd2+, Hg2+, схему анализа катионов VI группы.
Задачи:провести реакции обнаружения катионов меди (II), никеля (II), кобальта (II), кадмия (II) и ртути (II), отметить их особенности, оформить лабораторную работу, ответить на теоретические вопросы, сделать выводы.
Оборудование:штатив с пробирками, водяная баня, плитка, пипетки на 1 мл, спиртовка, держатели для пробирок, спички, предметные стекла, микроскоп, стеклянная палочка, фильтровальная бумага, стаканы, колбы, воронка для фильтрования, фарфоровые тигли, лакмусовая бумажка, стеклянный шпатель.
Реактивы:
6.1. Реакции катиона меди (II) Cu2+
Опыт 6.1.1. Действие группового реагента гидроксида аммония NH4OH
При взаимодействии сульфата меди с гидроксидом аммония образуется бледно-зеленый осадок основной соли меди:
2CuSO4 + NH4OH ® (CuОH)2SO4 ↓+ (NH4)2SO4
При избытке реактива осадок растворяется с образованием комплексного соединения ярко-синего цвета – сульфата тетераамминмеди (II):
(CuОH)2SO4 +( NH4)2SO4 + 6NH4OH ® 2[Cu(NH3)4] SO4 + 8Н2О
В кислой среде комплексный тетрамминмедь(II)-катион разрушается и окраска раствора из ярко-синей становится голубой (цвет аквокомплекса меди (II)).
Реакции мешают катионы Co2+, Ni2+, олово (II).
Реакция фармакопейная.
Выполнение опыта:
К небольшому количеству раствора соли меди прилить столько же гидроксида аммония. Наблюдать образование бледно-зеленого осадка основной соли меди.
К полученному осадку прилить избыток гидроксида аммония и наблюдать растворение осадка с образованием комплексной соли – сульфата тетераамминмеди (II) ярко-синего цвета.
Прибавить по каплям разбавленный раствор одной из кислот - HCl, HNO3 или H2SO4. Окраска раствора из ярко-синей переходит в голубую.
Записать наблюдения и уравнения реакции в тетрадь.
Дата добавления: 2020-11-18; просмотров: 648;











