Опыт 6.3.4. Реакция с сульфид-ионами
Катионы Hg2+ осаждаются из водных растворов сульфид-ионами S2- в виде черно-коричневого осадка сульфида ртути (II) HgS. Реакция протекает в несколько стадий. Вначале образуется белый осадок, постепенно изменяющий окраску через желто-красную и бурую на коричнево-черную при избытке сульфид-ионов.
Так, при действии сероводорода H2S на водный раствор хлорида ртути (II) HgCl2 сначала выпадает белый осадок состава 2HgSHgCl2:
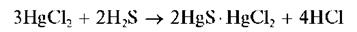
При избытке H2S белый осадок превращается в коричнево-черный
HgS:

Аналогично протекает реакция HgCl2 с сульфидом натрия Na2S. Сульфид ртути (II) HgS не растворяется в разбавленной азотной кислоте, но растворим в царской водке (смесь HCl + HNO3):
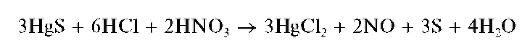
Реакция фармакопейная.
Выполнение опыта:
В пробирку внести 2-3 капли раствора хлорида ртути (II) HgCl2 и прибавить по каплям раствор сульфида натрия Na2S или сероводородной воды. Выпадает белый осадок, чернеющий при дальнейшем прибавлении раствора Na2S или сероводородной воды.
Записать наблюдения и уравнения реакции в тетрадь.
Опыт 6.3.5. Реакция с хлоридом олова (II)
Катионы Hg2+ восстанавливаются оловом (II) вначале до катионов Hg22+, а затем - до металлической ртути Hg. Так, при взаимодействии хлорида ртути (II) HgCl2 с хлоридом олова (II) образуется белый осадок каломели Hg2Cl2, который темнеет за счет выделения мелкодисперсной металлической ртути:

Мешают катионы Ag+, Hg22+, Sb(III), Bi(III).
Выполнение опыта:
В пробирку внести 2-3 капли раствора хлорида ртути (II) HgCl2 и прибавить по каплям солянокислый раствор хлорида олова (II). Выпадает белый осадок Hg2Cl2, который постепенно темнеет.
Реакцию можно проводить капельным методом на фильтровальной бумаге: при нанесении на бумагу капли раствора хлорида олова (II) и капли раствора хлорида ртути (II) появляется темное пятно.
Аналогично протекают реакции солей ртути (II) c некоторыми другими восстановителями, например, с металлической медью. Для проведения этой реакции на медную поверхность наносят каплю раствора соли ртути (II). На поверхности возникает темное (черно-серое) пятно, которое при протирании фильтровальной бумагой становится серебристо-блестящим.
Записать наблюдения и уравнения реакции в тетрадь. Рассмотреть реакцию с т.з. метода электронного баланса.
6.4. Реакции катиона кобальта (П) Co2+
Дата добавления: 2020-11-18; просмотров: 1044;











