Опыт 5.6.3. Реакция с сульфидами
Сульфид натрия Na2S в кислой среде образует с солями висмута (III) коричнево-чёрный осадок сульфида висмута(III):
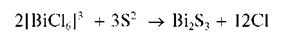
2Bi3+ + 3S2– = Bi2S3
Осадок не растворим в разбавленных растворах минеральных кислотах, кроме азотной кислоты:
Bi2S3 + 8HNO3 →2Bi(NO3)2 + 2NO + 3S + 4H2O
Осадок сульфида висмута (III) растворим также в растворе FeCl3 c выделением элементной серы:
Bi2S3 + 6FeCl3 →2BiCl3 + 6FeCl2 + 3S
Реакция фармакопейная.
Выполнение опыта:
В пробирку внести 3 - 4 капли солянокислого раствора хлорида висмута (III) и прибавить по каплям раствор (NH4)2S, или Na2S, или сероводородной воды. Выпадает черно-коричневый осадок сульфида висмута Bi2S3. Изучить отношение осадка к азотной кислоте и к хлориду железа (III), разделив содержимое пробирки на 2 части и слив надосадочную жидкость.
Записать наблюдения и уравнение реакции в молекулярном и молекулярно-ионном виде в тетрадь.
Опыт 5.6.4. Реакция с иодид-ионами
Иодид калия KI осаждает из кислых растворов солей висмута черный осадок BiI3, растворимый в избытке реагента с образованием комплексного иона желто-оранжевого цвета тетраиодовисмутата (III) [BiI4]–:
Bi3+ + 3 I– →BiI3↓
BiI3 + KI →K[BiI4]
Проведению реакции мешают ионы железа (III) и меди (II), которые в кислой среде окисляют иодид-ионы до элементарного иода.
Разбавление полученного раствора водой приводит к выпадению осадка BiI3 с последующим его гидролизом и образованием желто-оранжевого оксоиодида висмута BiOI (иодида висмутила). Суммарно реакцию гидролиза можно описать схемой:
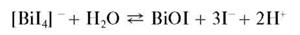
Реакция фармакопейная.
Выполнение опыта:
В пробирку внести около 5 капель солянокислого раствора хлорида висмута (III) и прибавить по каплям раствор KI до выпадения черного осадка йодида висмута (III). Дальнейшее прибавление избытка раствора KI приводит к растворению осадка и появлению оранжевого окрашивания раствора. При последующем прибавлении воды к этому раствору и его нагревании образуется оранжевый осадок йодида висмутила BiOI.
Записать наблюдения и уравнение реакции в молекулярном и молекулярно-ионном виде в тетрадь.
Опыт 5.6.5. Реакциявосстановления висмута (III) до висмута (0) станнитом натрия Na2SnO2
В щелочной среде рН=10 олово (II) SnCl2 восстанавливает висмут (III) до металлического висмута (0), выделяющегося в виде черного осадка. Олово (II) при этом окисляется до олова (IV):
Bi(NO3)3 + 3NaOH →Bi(OH)3↓ + 3NaNO3
2Bi(OH)3 + 3Na2SnO2 →2Bi↓ + 3Na2SnO3 + 3H2O
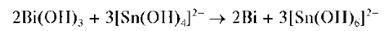
Следует избегать прибавления концентрированной щелочи, а также нагревания, поскольку в этих условиях может выпасть черный осадок металлического олова вследствие разложения Na2SnO2 и протекания реакции диспропорционирования:
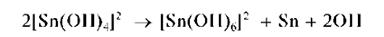
При недостатке щелочи может выпасть черный осадок оксида оло-ва (II) SnO:
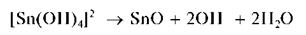
Проведению реакции мешают ионы серебра, ртути и меди (I и II).
Выполнение опыта:
В пробирку внести 2 капли солянокислого раствора хлорида олова (II), 8-10 капель 2 моль/лраствора NaOH до растворения первоначально выпавшего осадка Sn(OH)2 и добавить 1-2 капли раствора соли висмута (III). Выпадает осадок черного цвета - металлический висмут.
Записать наблюдения и уравнение реакции в молекулярном и молекулярно-ионном виде. Окислительно-восстановительные реакции рассмотреть с помощью метода электронного баланса.
Опыт 5.6.6. Реакция с с тиокарбамидом (тиомочевиной)
Висмут (III) при взаимодействии с тиокарбамидом SC(NH2)2 в кислой среде образует растворимый комплекс желтого цвета состава [BiL3]3+, где L - условное обозначение молекулы тиокарбамида:
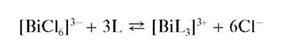
Мешают реакции катионы Hg22+,Fe3+.
Выполнение опыта:
На предметное стекло наносят каплю солянокислого раствора хлорида висмута (III) и добавляют кристаллик тиокарбамида. Капля окрашивается в оранжевый цвет.
Записать наблюдения и уравнение реакции в тетрадь.
5.6. Реакции катиона марганца Mn2+
Опыт 5.6.1. Действие щелочей и аммиака (группового реагента)
При взаимодействии соли марганца с гидроксидом натрия (калия) образуется белый студенистый осадок, буреющий на воздухе вследствие окисления двухвалентного катиона марганца (II) до катиона марганца (IV):
Mn(NO3)2 + 2NaOH ® Mn(OH)2↓ + 2NaNO3
2Mn(OH)2+ O2 ® 2MnO(OH)2↓ (или H2MnO3 – марганцовистовая кислота)
При действии щелочей на растворы солей марганца (II) в присутствии пероксида водорода образующийся вначале гидроксид марганца (II) Mn(OH)2 окисляется пероксидом водорода до черно-коричневого MnO(OH)2:
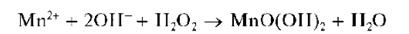
Осадок Mn(OH)2 растворяется в разбавленных растворах сильных кислот и в насыщенном растворе хлорида аммония:
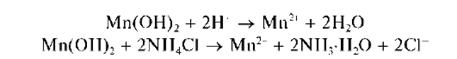
Осадок MnO(OH)2 не растворяется при действии этих реагентов.
Выполнение опыта:
К небольшому количеству раствора соли марганца прилить по каплям немного щелочи NaOH до прекращения выпадения белого осадка Mn(OH)2. Разделить осадок на две пробирки. В одной пробирке наблюдать изменение окраски осадка при стоянии (оставить ее без изменений на время).
В другую пробирку к свежевыпавшему осадку Mn(OH)2, полученному, как описано выше, прибавить по 3-4 капли растворов NaOH и H2O2. Белый осадок Mn(OH)2 переходит в черно-коричневый MnO(OH)2.
Записать наблюдения и уравнение реакции в тетрадь.
Опыт 5.6.2. Реакция окисления катиона двухвалентного марганца до аниона марганцевой кислоты MnO4-.
Катионы Mn2+ под действием различных окислителей окисляются до перманганат-ионов MnO4-, окрашивающих раствор в малиново-фиолетовый цвет. В качестве окислителей применяют висмутат натрия NaBiO3, персульфат аммония (NH4)2S2O8, диоксид свинца PbO2 и др. Чаще всего используют висмутат натрия. Реакцию окисления катионов Mn2+ до MnO4- используют для открытия этих катионов в растворе.
Реакции окисления проводят в отсутствие хлорид-ионов Cl- , так как они восстанавливаются перманганат-ионами до хлора Cl2:
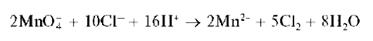
а) Окисление висмутатом натрия в кислой среде протекает по схеме:
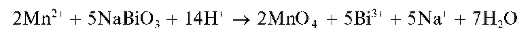
Избыток висмутата натрия может маскировать окраску раствора.
б) Окисление персульфатом аммония. Реакцию проводят в кислой среде в присутствии катализатора - солей серебра (AgNO3) при нагревании:
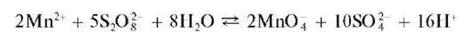
В качестве катализатора применяют также соли кобальта и меди.
В горячем растворе возможно разложение перманганат-ионов, которое замедляется в присутствии фосфорной кислоты H3PO4.
в) Окисление диоксидом свинца в кислой среде при нагревании:
Эта реакция характерна для иона марганца, но ей мешают ионы хлора и другие восстановители, а также присутствие большого количества солей Mn2+:
MnSO4 + PbO2 + HNO3 ® Pb(NO3)2 + PbSO4 + H2O + НMnO4
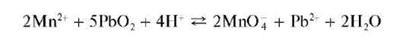
При избытке соли марганца (II) образуется MnO(OH)2, а не перманганат-ион.
Выполнение опыта:
а) В пробирку внести 5 капель концентрированной HNO3, несколько крупинок висмутата натрия. Смесь перемешать и прибавить к ней 1-2 капли раствора сульфата MnSO4 или нитрата Mn(NO3)2 марганца (II) (но не хлорида MnCl2!). Раствор окрашивается в малиново-фиолетовый цвет.
б) В пробирку внести несколько кристалликов (NH4)2S2O8 (или 0,5 мл насыщенного раствора (NH4)2S2O8), прибавить 2 мл раствора HNO3 (или H2SO4), 2-3 капли раствора AgNO3 и 1-2 капли концентрированного раствора H3PO4. Нагреть смесь до кипения и прибавить каплю раствора соли марганца (II). Раствор окрашивается в малиновый цвет.
в) Внести в пробирку стеклянным шпателем немного диоксида свинца PbO2 или сурика Pb3O4 (2PbO×PbO2), добавить несколько капель HNO3 (концентрация 1:1) и осторожно нагреть до кипения. Затем поместить в пробирку с помощью стеклянной палочки каплю соли марганца, перемешать и снова нагреть. Дать осесть избытку диоксида свинца и наблюдать красно-фиолетовую окраску образовавшейся марганцевой кислоты.
Записать наблюдения и составить электронные уравнения реакции, расставить коэффициенты.
Опыт 5.6.3. Реакция с сульфид-ионами
Катионы Mn2+ с сульфид-ионами S2- образуют осадок сульфида марганца (II) MnS розовато-телесного цвета:
Mn2+ + S2- ® MnS↓
Осадок растворяется в разбавленных кислотах.
Выполнение опыта:
В пробирку внести 3-4 капли раствора соли марганца (II) и прибавить 1-2 капли раствора сульфида аммония (NH4)2S (или сульфида натрия Na2S) или сероводородной воды. Выпадает осадок сульфида марганца (II) телесно-розового цвета.
Записать наблюдения и составить молекулярные и молекулярно-ионные уравнения реакции.
Контрольные вопросы
1. Назовите групповые реагенты на катионы пятой аналитической группы.
2. Перечислите катионы, входящие в состав этой группы.
3. Какие элементы, катионы которых входят в состав пятой группы, проявляют переменную степень окисления?
6. Напишите в ионном виде уравнение реакции окисления марганца (II) с висмутатом натрия.
7. Какие катионы пятой группы подвергаются гидролизу?
8. Напишите в ионном виде уравнения реакций взаимодействия: а) соли железа (II) с гексацианоферратом (III) калия;б) соли железа (III) с гексацианоферратом (II) калия. В какой среде протекают эти реакции?
9. Напишите в ионном виде уравнение реакции взаимодействия нитрата висмута (III) с хлоридом олова (II). В какой среде протекает эта реакция?
10. Напишите реакцию окисления гидроксида марганца (II) с кислородом воздуха. Что наблюдается при этом?
11. Перечислите аналитические реакции катиона магния. Какие из них наиболее характерны?
12. Какой катион пятой группы обладает выраженными амфотерными свойствами?
13. Какие реакции используют для обнаружения катиона железа (III)? Напишите их уравнения в ионном виде.
14. Как действуют растворы щелочей и аммиака на катионы пятой аналитической группы? Напишите соответствующие уравнения реакций.
15. Какую окраску имеют гидроксиды катионов пятой группы?
16. Реакцию гидролиза каких ионов пятой группы используют для их обнаружения? Напишите уравнения соответствующих реакций.
17. Как отличить осадки SbOCl и BiOCl друг от друга?
18. Объясните с позиции протолитической теории растворение осадка гидроксида магния в насыщенном растворе хлорида аммония.
19. Какую роль играет хлорид аммония и аммиак при осаждении иона магния гидрофосфатом натрия? Составьте соответствующие уравнения реакций.
20. Как действует пероксид водорода в щелочной среде на железо (II) и марганец (II)? Напишите уравнения соответствующих реакций и укажите цвет продуктов реакции.
21. Какую окраску имеют сульфиды сурьмы (III) и сурьмы (V)? Из каких растворов они выделяются?
22. Летучие соли каких ионов пятой группы окрашивают пламя газовой горелки? Укажите цвет пламени.
Глава 6
Дата добавления: 2020-11-18; просмотров: 1380;











