Действие группового реагента.
Групповым реагентом на V группу катионов является раствор гидроксида натрия в присутствии пероксида водорода или аммиака. В этом случае ионы переменной степени окисления находятся в степени окисления Mn (IV), Fe (III) и Sb (V). При действии группового реагента катионы пятой аналитической группы осаждаются из водного раствора в виде гидроксидов Mg(OH)2, Mn(OH)2, Fe(OH)2,Fe(OH)3, Sb(OH)3, SbO(OH)3, Bi(OH)3. Гидроксиды катионов пятой аналитической группы не растворяются в избытке группового реагента, в отличие от катионов четвертой аналитической группы.
Катионы V группы при взаимодействии с растворами сильных оснований образуют осадки гидроксидов, нерастворимые в избытке гидроксидов или водном растворе аммиака, но растворимые в кислотах.
Нитраты, хлориды, сульфаты железа и марганца хорошо растворимы в воде. Соли висмута и сурьмы при растворении легко гидролизуются с образованием бесцветных основных солей. Сульфиды, карбонаты и фосфаты катионов V группы малорастворимы в воде.
Выраженные окислительно-восстановительные свойства в водных растворах проявляют ионы марганца, железа и сурьмы.
Реакции с сильными основаниями. Растворы сильных оснований (гидроксиды калия и натрия) образуют с катионами V группы бесцветные осадки гидроксидов Mn(OH)2, Bi(OH)3, Sb(OH)3, SbO(OH)3, а также Fe(OH)2 зеленоватого цвета и Fe(OH)3 — буро-красного цвета.
Гидроксиды железа(II) и марганца(II) при взаимодействии с кислородом воздуха превращаются в продукты окисления буро-коричневого цвета:
2Mn(OH)2 + O2 → 2MnO(OH)2↓
4Fe(OH)2 + O2 + 2 H2O → 4Fe(OH)3↓
При действии сильных оснований на растворы катионов V группы в присутствии пероксида водорода сразу образуются гидроксиды железа (III), марганца (IV), сурьмы (V), висмута (III).
Гидроксиды железа (II и III) и марганца (II) хорошо растворимы в сильных минеральных кислотах. Гидроксид марганца (IV) растворяется в кислотах в присутствии восстановителя (пероксида водорода). Гидроксиды сурьмы (III и V) растворяются в соляной кислоте с образованием комплексных анионов [SbCl6]3– и [SbCl6]–, при растворении в азотной кислоте образуется малорастворимая сурьмяная кислота HSbO3.
Реакции с сульфидами. Растворимые сульфиды образуют с катионами V группы (кроме ионов магния) аморфные осадки:
• сульфидов железа (II и III), висмута(III) - черного цвета;
• сульфида марганца (II) - розоватого цвета;
• сульфидов сурьмы (III и V) - оранжевого цвета.
Сульфиды железа и марганца растворимы в кислотах соляной, серной и азотной, а сульфид висмута — в азотной. Сульфиды сурьмы растворимы в растворах гидроксида и сульфида натрия и в растворах соляной кислоты:
Sb2S3↓ + 6NaOH→ Na3SbS3 + Na3SbO3 + 3H2O
Sb2S3↓ + 3Na2S → 2Na3SbS3
Sb2S3↓ + 12HCl → 2H3SbCl6 + 3H2S
Таблица 5.1
Схема систематического хода анализа катионов V аналитической группы Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb(III), Sb(V)
| № этапа | Этапы исследования |
| 1. | Определение Fe(II), Fe(III) ионов в отдельной пробе с реагентами K3[Fe(CN)6] и K4[Fe(CN)6] соответственно: Fe2+ K3[Fe(CN)6] Fe3[Fe(CN)6]2↓ Fe3+ K4[Fe(CN)6] Fe4[Fe(CN)6]3↓ |
| 2. | Отделенение Sb(III) и Sb(V) ионов действием HNO3 и Н2О2: Sb(III), Sb(V) HNO3; H2O2 HSbO3↓ |
| 3. | Растворение осадка № 2 в растворе HCl: HSbO3↓ HCl [SbCl6]ˉ |
| 4. | Определение Sb(V) катиона в растворе № 3 действием цинка на никелевой пластине: [SbCl6]ˉ Zn Sb↓ |
| 5. | Осаждение катионов V аналитической группы из центрифугата №2 действием концентрированного раствора NH3 * H2O: Mg2+ NH3 * H2O Mg(OH)2↓ Mn2+ NH3 * H2O Mn(OH)2↓ Fe3+ NH3 * H2O Fe(OH)3↓ Bi3+ NH3 * H2O BiONO3↓ |
| 6. | Отделение Mg2+ катионов действием на осадок №5 насыщенным раствором NH4Cl и 3% раствором Н2О2: Mg(OH)2↓ NH4Cl Mg2+ |
| 7. | Определение Mg2+ катиона в центрифугате № 6 действием Na2HPO4 в присутствии аммиачного буферного раствора: Mg2+ Na2HPO4, NH3 *H2O+NH4Cl MgNH4PO4↓ |
| 8. | Отделение Bi3+ и Fe3+ катионов действием раствора HNO3 на осадок № 6: BiONO3↓ HNO3 Bi3+ Fe(OH)3↓ HNO3 Fe3+ |
| 9. | Растворение осадка MnO2 * nH2O, полученного по п. 8, действием раствора HNO3 в присутствии Н2О2: MnO2*nH2O↓ HNO3; H2O2 Mn2+ |
| 10. | Определение Mn2+ катиона действием на раствор № 9 (NH4)S2O8: Mn2+ (NH4)S2O8; HNO3; AgNO3 MnOˉ4 |
| 11. | Определение Bi3+ катиона в центрифугате №8 действием свежеприготовленного [Sn(OH)6]4ˉ : Bi3+ [Sn(OH)6]4ˉ Bi↓ |
Работа 5. Реакции катионов пятой группы
Цель: изучить характерные качественные реакции наиболее распространенных катионов V группы, схему анализа катионов V группы.
Задачи:провести реакции обнаружения катионов магния, марганца (II), висмута (III), железа (II) и железа (III), сурьмы (III) и сурьмы (V), отметить их особенности, оформить лабораторную работу, ответить на теоретические вопросы, сделать выводы.
Оборудование:штатив с пробирками, водяная баня, плитка, пипетки на 1 мл, спиртовка, держатели для пробирок, спички, предметные стекла, микроскоп, стеклянная палочка, фильтровальная бумага, стаканы, колбы, воронка для фильтрования, фарфоровые тигли, лакмусовая бумажка, стеклянный шпатель.
Реактивы:
| 1. | хлорид магния MgCl2 | 2. | соли висмута (III) |
| 3. | соли железа (II) | 4. | соли железа (III) |
| 5. | солянокислый раствор сурьмы (V) | 6. | солянокислый раствор сурьмы (III) |
| 7. | гидроксид магния Mg(OH)2 | 8. | Na2HPO4 гидрофосфат натрия |
| 9. | марганца сульфат MnSO4 или нитрат Mn(NO3)2 | 10. | гидроксид калия КОН - 2М раствор |
| 11. | нитрат серебра AgNO3 | 13. | карбонат аммония (NН4)2СO3 |
| 14. | хлорид аммония NH4Cl – 4М раствор и сухая соль | 15. | 8-оксихинолин C9H6NOH |
| 16. | гидроксид натрия NaOH - 2 М и 20% растворы | 17. | хинализарин - спиртовой раствор |
| 18. | соляная кислота HCl - 2 М, конц., 10% раствор | 19. | серная кислота H2SO4 – 2М раствор |
| 20. | гидроокись аммония, раствор аммиака NH4OH – конц., 25%, 2М раствор | 21. | сульфид натрия Na2S или аммония (NH4)2S – свежеприготовленный раствор |
| 22. | гексацианоферрат (II) калия K4[Fe(CN)6] - насыщенный свежеприготовленный раствор | 23. | гексацианоферрат (III) калия К3[Fe(CN)6] - насыщенный свежеприготовленный раствор |
| 24. | 0,06 % водный раствор метилового фиолетового или родамина Б | 25. | магнезон 1 - п-нитробензолазорезорцин – щелочной раствор |
| 26. | NH4Cl и NH4OH (аммиачный буферный раствор) | 27. | перикись водорода Н2О2 - 3 % и 10% раствор |
| 28. | азотная кислота НNO3 – конц. 1:1, 32% р-р | 29. | фторид натрия или калия NaF или KF |
| 30. | тиционата аммония NH4SCN | 31. | сульфосалициловая кислота |
| 12. | тиосульфат натрия Na2S2O3 - кристаллич. | 13. | металлический алюминий или цинк, либо железо |
| 14. | α,α‘-дипиридил | 15. | оловянная фольга |
| 16. | раствором висмутата натрия NaBiO3 | 17. | нитрит калия KNO2 - 1М раствор |
| 18. | мочевина CO(NH2)2 - насыщенный раствор | 19. | йодид калия KI |
| 20. | бензол | 21. | хлорид олова (II) |
| 22. | фосфорная кислота H3PO4 - концентрированный раствор | 23. | тиокарбамид (тиомочевина) SC(NH2)2 |
| 24. | диоксид свинца PbO2 или сурик Pb3O4 (2PbO×PbO2) | 25. | висмутат натрия NaBiO3 - кристаллич. |
| 26. | персульфат аммония (NH4)2S2O8 – сухая соль или насыщенный раствор | 27. | Диметилглиоксим (2,3-бутандиондиоксим, диоксим диацетила) |
| 28. | 0,075%-ный раствор титанового желтого: 18,7 мг вещества растворяют в 25 мл воды, хранят в холодильнике в темной склянке (реактив очень светочувствителен, годен не более 10 дней). |
5.1. Реакции катиона магния Mg2+
Опыт 5.1.1. Действие щелочей и аммиака (группового реагента)
При действии группового реагента (водного раствора щелочи или аммиака) катионы пятой аналитической группы, в том числе и катион магния, осаждаются из водного раствора в виде белого аморфного осадка гидроксида магния Mg(OH)2:
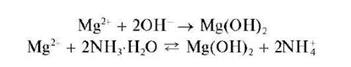
При реакции с аммиаком достигается неполное осаждение катионов Mg2+, так как гидроксид магния частично растворяется в растворах солей аммония (особенно в концентрированных) вследствие смещения равновесия влево при увеличении концентрации катионов аммония.
Осадок Mg(OH)2 не растворяется в щелочах, но растворяется в кислотах:
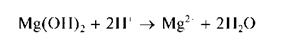
Выполнение опыта:
В две пробирки внести по 5-6 капель раствора соли магния и прибавить по каплям: в одну - раствор NaOH, в другую - раствор аммиака до выпадения белого аморфного осадка. Надосадочную жидкость слить и в обе пробирки добавить избыток соответствующего реактива.
Осадок магния гидроксида проверить на растворимость в насыщенном растворе аммония хлорида.
Записать наблюдения и уравнения реакций в молекулярном и молекулярно-ионном виде.
Опыт 5.1.2. Реакция с гидрофосфатом натрия Na2HPO4
Гидрофосфат натрия с ионом магния в присутствии NH4Cl и NH4OH (аммиачный буферный раствор) образует белый кристаллический осадок двойной соли фосфата магния-аммония:
MgCl2 + Na2HPO4 + NH4OH ® MgNH4PO4↓ + 2NaCl + H2O
При проведении реакции катионов Mg2+ с гидрофосфатом натрия в отсутствии катионов аммония и аммиака выпадает белый аморфный осадок гидрофосфата магния MgHPO4. Раствор NH4Cl используют для предотвращения выпадения иона Mg2+ в виде Mg(OH)2, когда к раствору добавляют NH4OH. Осадок фосфата магния-аммония растворим в минеральных кислотах и даже в уксусной кислоте, поэтому реакцию выполняют в нейтральном или слабощелочном растворе.
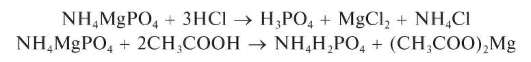
Реакция образования NH4MgPO4 достаточно чувствительна: предел обнаружения 0,010 мкг (подругим данным - около10 мкг), предельное разбавление - 8,3 104 мл/г. Мешают катионы Li+,Ca2+,Sr2+,Ba2+ и другие, дающие малорастворимые фосфаты.
Реакцию можно проводить как микрокристаллоскопическую.
Реакция фармакопейная.
Выполнение опыта:
Первый вариант. Для проведения реакции к 1-2 мл соли магния прибавить столько же раствора NH4Cl. Затем добавить 1-2 мл 2н раствора NH4OH до щелочной реакции лакмуса (или появления запаха аммиака). К полученной смеси прилить 1-2 мл раствора Na2HPO4 и перемешать.
Из концентрированных растворов выпадают игольчатые кристаллы MgNH4PO4. Поместить каплю осадка на предметное стекло и рассмотреть кристаллы под микроскопом.
Второй вариант. В пробирку вносят по одной капле растворов соли магния, NH4Cl и концентрированного аммиака. Каплю смеси наносят на предметное стекло и рядом помещают каплю раствора Na2HPO4. Приводят капли в соприкосновение и через 1-3 мин наблюдают под микроскопом образование прозрачных бесцветных кристаллов магнийаммонийфосфата.
Составить молекулярно-ионное уравнение реакции, зарисовать наблюдаемые кристаллы в тетрадь.
Опыт 5.1.3. Реакция с магнезоном 1 - п-нитробензолазорезорцином
В щелочной среде магнезон I, имеющий красную окраску, или магнезон II (n-нитробензолазо-а-нафтол) образует с катионами Mg2+ комплекс синего цвета, сорбирующийся на осадке гидроксида магния:
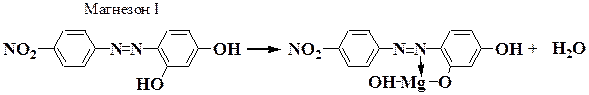
Реакция основана на осаждении Mg(OH)2 с последующей адсорбцией красителя на поверхности гидроокиси магния.
Реакция высокочувствительна: предел обнаружения - 0,5 мкг. Мешают многие катионы (Cd2+,Sn2+,Cr3+,Fe2+,Co2+,Ni2+ и др.), также образующие окрашенные комплексы с магнезоном.
Выполнение опыта:
Первый вариант. К 2–3 каплям раствора MgCl2 прибавить 1 каплю щелочного раствора магнезона. Переход красно-фиолетовой окраски в синюю свидетельствует о наличии ионов магния. Если раствор окрасился в желтый цвет (рН < 7), добавить несколько капель щелочи.
Второй вариант. На предметное стекло нанести каплю раствора соли магния и прибавитьт каплю щелочного раствора магнезона. Образуется синий осадок. При малых концентрациях катиона магния осадок не выделяется, а раствор окрашивается в синий цвет.
Записать наблюдение и уравнение реакции в тетрадь.
Опыт 5.1.4. Реакция с 8-оксихинолином C9H6NOH
Ионы Mg2+ в аммиачной среде (рН = 9-10) (лучше - при нагревании) с 8-оксихинолином образуют зеленовато-желтый осадок оксихинолята магния Mg(C9H6NO)2:
Mg2+ + 2 C9H6NOH → Mg(C9H6NO)2 + 2H+
8-оксихинолин – комплексное соединение, флуоресцирующее зеленым светом. Осадок оксихинолината магния растворим в минеральных кислотах и в уксусной кислоте.
Реакция высокочувствительна: предел обнаружения - 0,25 мкг. Мешают катионы, также образующие комплексы с 8-оксихинолином (Al3+, Zn2+, Cu2+,Zn2+,Cd2+,Fe3+ и др.).
Выполнение опыта:
В пробирку внести 2-3 капли раствора хлорида магния, 2 капли раствора аммиака и прибавить по каплям раствор хлорида аммония (аммиачная буферная смесь) до растворения первоначально выпавшего белого осадка гидроксида магния Mg(OH)2. К раствору прибавить по каплям, перемешивая стеклянной палочкой, раствор 8-оксихинолина до выпадения желто-зеленого осадка.
Записать наблюдение и уравнения реакций в тетрадь.
Опыт 5.1.5. Реакция с хинализарином
Катион Mg2+ при взаимодействии с хинализарином в щелочной среде дает синий осадок комплексного соединения - хинализарината магния состава MgL(OH), где L - условное обозначение молекулы хинализарина:
Mg2+ + 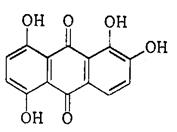 =
= 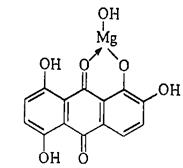
Раствор самого хинализарина в щелочной среде имеет фиолетовую окраску. При небольшом содержании катионов магния в растворе осадок не выпадает, а раствор окрашивается в васильково-синий цвет.
Реакция высокочувствительна: предел обнаружения - 0,25 мкг.Мешают катионы алюминия.
Выполнение опыта:
В пробирку внести 3-4 капли раствора MgCl2, 2-3 капли спиртового раствора хинализарина и 2-3 капли раствора NaOH. Выпадает синий осадок хинализарината магния, а раствор окрашивается в васильково-синий цвет.
Записать наблюдение и уравнение реакции в тетрадь.
Опыт 5.1.6. Реакция с титановым желтым
Магний в щелочной среде образует комплекс красного цвета с титановым желтым, присутствие гидроксиламина стабилизирует окраску. Открываемый минимум 1,5 мкг. Щелочные и щелочноземельные металлы не мешают реакции, другие ионы могут мешать или уменьшать чувствительность реакции, ионы кальция и бария усиливают окраску.
Реакцию используют в медицине при определении содержания магния в биологических жидкостях.
Выполнение опыта:
К 2-3 каплям раствора, содержащего ион Мg2+ (рН ≥ 7), приливают 2-3 капли титанового желтого и 1 мл 2М КОН. В присутствии ионов магния раствор окрашивается в красный цвет, при слабом подогреве выпадает красный осадок.
Опыт 5.1.7. Реакция с карбонатом аммония (NН)2СО3
Карбонат аммония в отсутствие аммонийных солей дает с растворами солей магния белый аморфный осадок основной соли оксикарбоната магния Mg 2(OH)2СО3:

 2Mg2++ 4NН4+ + 2СО32- + Н2О = Mg 2(OH)2СО3 + 4NН4+ + СО2
2Mg2++ 4NН4+ + 2СО32- + Н2О = Mg 2(OH)2СО3 + 4NН4+ + СО2
Выполнение опыта:
В две пробирки налить по 5-6 капель раствора соли магния. В одну из них прилить равный объем хлорида аммония. Затем в обе пробирки прилить по 5-6 капель раствора реактива. Пробирки нагреть почти до кипения. Сравнить полученные результаты и убедиться, что в присутствии хлорида аммония осадок не выпадает.
Составить уравнения реакций в молекулярной и ионной форме, записать наблюдения в тетрадь.
5.2. Реакции катиона железа (II) Fe2+
Опыт 5.2.1. Действие щелочей и аммиака (группового реагента)
Катионы Fe2+ образуют с щелочами и аммиаком белый осадок гидроксида железа (II) Fe(OH)2:
Fe2+ + 2ОН- ® Fe(OH)2 ↓
Гидроксид Fe(OH)2 растворяется в кислотах, но не растворяется в щелочах. При стоянии на воздухе гидроксид железа (II) Fe(OH)2 постепенно темнеет вследствие окисления железа (II) до железа (III) кислородом воздуха и образования красно-бурого гидроксида железа (III) Fe(OH)3:
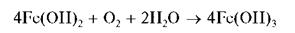
При действии щелочей на растворы солей железа (II) в присутствии пероксида водорода сразу образуется красно-бурый осадок Fe(OH)3 гидроксида железа (III):
2Fe2+ + 4ОН- + Н2О2 ® 2Fe(OH)3 ↓
Выполнение опыта:
В пробирку внести 5-6 капель раствора соли железа (II) и по каплям прибавляют раствор NaOH до прекращения выпадения белого осадка Fe(OH)2. На воздухе осадок постепенно темнеет и приобретает серозеленый цвет за счет образования гидроксида железа (III).
К свежеприготовленному, как описано выше, белому осадку Fe(OH)2 прибавляют по 2-3 капли растворов NaOH и H2O2. Окраска осадка изменяется до красно-бурой.
Составить уравнения реакций в молекулярной и ионной форме, записать наблюдения в тетрадь.
Опыт 5.2.2. Действие гексацианоферрата (III) калия К3[Fe(CN)6]
Гексацианоферрат (III) калия – красная кровяная соль образует с катионами железа Fe2+ темно-синий осадок, называемый «турнбулевой синью»:
3FeSO4 + 2K3[Fe(CN)6] →Fe3[Fe(CN)6]2↓+ 3K2SO4
3Fe2+ + 2[Fe(CN)6]3- ® Fe3[Fe(CN)6]2↓
Осадок разлагается щелочами, в кислотах практически нерастворим. При избытке реактива осадок приобретает зеленый оттенок. Реакции мешают ионы Fe3+, которые при большой концентрации дают с реактивом бурое окрашивание раствора, и ионы Мn2+ и Bi3+, дающие с реактивом слабоокрашенные осадки, растворимые в кислотах, а также ион Zn2+. Реакция очень чувствительна: предел обнаружения - 0,05 мкг. Условия проведения реакции – с разбавленными растворами в кислой среде, рН = 3.
Выполнение опыта:
В пробирку налить 1-2 мл раствора соли железа (II) и добавить такое же количество раствора гексацианоферрата (III) калия. Полученный осадок разделить на две части, к первой прибавить 1-2 капли 2 Мраствора НСl, ко второй – 1-2 капли 2 Мраствора щелочи.
Отметить цвет полученного осадка, его отношение к кислотам и щелочам. Записать уравнения реакций, назвать продукт реакции.
Опыт 5.2.3. Реакция с сульфид-ионами
Катионы Fe2+ образуют с сульфид-ионами в нейтральной или аммиачной среде черный осадок сульфида железа (II) FeS:
Fe2+ + S2- ® FeS↓
Осадок растворяется в разбавленных минеральных кислотах и в уксусной кислоте.
Реакция фармакопейная.
Выполнение опыта:
В пробирку внести 3-4 капли раствора соли железа (II) и прибавить 2-3 капли раствора сульфида аммония (или сульфида натрия). Наблюдать выпадение черного осадка сульфида железа (II).
Составить уравнения реакций в молекулярной и ионной форме, записать наблюдения в тетрадь.
Опыт 5.2.4. Реакция с диметилглиоксимом (реактивом Чугаева)
Диметилглиоксим (HON=C(CH3)–C(CH3)=NOH 2,3-бутандиондиоксим, диоксим диацетила) образует с ионами Fe2+ в аммиачной среде комплекс красного цвета:
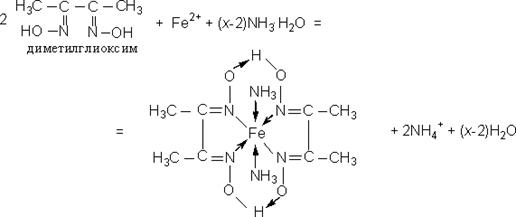
При действии пероксида водорода раствор обесцвечивается и выпадает бурый осадок гидроксида железа (III). Если в растворе есть примесь Fe3+, то одновременно может выпасть бурый осадок гидроксида железа (III). В этом случае реакцию проводят в присутствии винной кислоты. Определению мешают ионы Ni (II), которые образуют нерастворимый в воде диметилглиоксимат никеля красного цвета, а также ионы Mn2+.
Выполнение опыта:
Для проведения эксперимента на предметное стекло поместить каплю анализируемого раствора соли железа двухвалентного, добавить каплю реактива и каплю гидроксида аммония (реакция проводится в аммиачной среде при рН ≈ 9). Раствор окрашивается в карминово-красный цвет.
Другой способ. K 4 каплям раствора соли Fe2+ добавить несколько капель раствора диметилглиоксима и раствора NH3. Раствор окрашивается в красный цвет. Добавить несколько капель Н2О2. Ионы Fe2+ окисляются до Fe3+, и наблюдается исчезновение красной окраски.
Записать наблюдения и уравнение реакции в тетрадь.
Опыт 5.2.5. Реакция окисления Fe2+ до Fe3+
Ион Fe2+ представляет собой довольно сильный восстановитель и способен окисляться при действии ряда окислителей, например, H2O2, KMnO4, K2Cr2O7 в кислой среде:
 6FeSO4 + 3H2SO4 + 2HNO3 → 3Fe2(SO4)3 + 2NO + 4H2O
6FeSO4 + 3H2SO4 + 2HNO3 → 3Fe2(SO4)3 + 2NO + 4H2O
или
2Fe2+ + 4OH– + H2O2 → 2Fe(OH)3↓
При проведении систематического анализа Fe2+ следует открыть в предварительных испытаниях, т.к. в процессе разделения групп Fe2+ может окислиться до Fe3+.
Выполнение опыта:
К 3-4 каплям раствора соли железа (II) прибавить 3 капли 2н раствора серной кислоты и 2-3 капли 32% раствора азотной кислоты. Смесь нагреть до исчезновения бурой окраски.
Составить уравнения электронного балланса, записать наблюдения в тетрадь.
Опыт 5.2.6. Реакция с α,α‘-дипиридилом
Катионы Fe2+ образуют в кислой среде с α,α‘-дипиридилом или о-фенантролином устойчивые комплексные соединения розово-красного цвета:
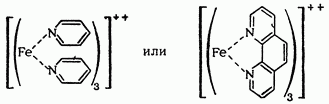
Реакция протекает в кислой среде при рН 1-2, большие количества Fe3+ маскируют добавлением нескольких кристаллов NaF или KF.
Выполнение опыта:
К 1-2 каплям подкисленного анализируемого раствора добавляют 1-2 капли раствора α,α‘-дипиридила и несколько кристалликов фторида натрия или калия (если присутствуют ионы Fe3+). Наблюдают появление темно-красной или розовой окраски раствора.
Записать наблюдения и строение образовавшегося комплекса в тетрадь.
5.3. Реакции катиона железа (III) Fe3+
Опыт 5.3.1. Действие щелочей и аммиака (группового реагента)
Катионы Fe3+ при взаимодействии со щелочами и аммиаком в водных растворах образуют красно-бурый осадок гидроксида железа (III):
Fe3+ + 3ОН- ® Fe(ОН)3↓
Осадок растворим в разбавленных кислотах; не растворяется в насыщенном растворе хлорида аммония (в отличие от белого осадка гид-роксида железа (II) Fe(OH)2), а также, в растворах щелочей.
Выполнение опыта:
В пробирку внести 3-4 капли раствора соли железа (III) и прибавить 3-4 капли раствора NaOH. Выпадает красно-бурый осадок гидроксида железа (III) Fe(OH)3.
Записать наблюдения и уравнения реакции в тетрадь.
Опыт 5.3.2. Действие тиоционата аммония NH4SCN
Катионы Fe3+ реагируют с тиоцианат-ионами NCS- (лучше - в кислой среде при рН = 3) с образованием тиоцианатных комплексов железа (III) красного цвета. В зависимости от соотношения концентраций реагентов могут доминировать комплексы различного состава [Fe(NCS)n (H2O)6-n]3- n,где n=1, 2, 3, 6. Все они имеют красную окраску и находятся в равновесии. Для подавления образования гидроксокомплексов, содержащих гидроксильные группы OH-, реакцию проводят в кислой среде при рН = 3. Реакция протекает по схеме:
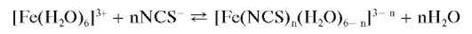
Fe3+ + SCN- ® [Fe(SCN)]2+
Реакция высокочувствительна: предел обнаружения катионов же-леза (III) составляет 0,25 мкг.Мешают многие вещества: окислители, восстановители, ртуть (II), фториды, йодиды, фосфаты, цитраты, тарт-раты и др. соединения. Катионы железа (II) Fe2+ не мешают.
Эта реакция является специфической на ион железа Fe3+.
Реакция фармакопейная.
Выполнение опыта:
К 1-2 мл раствора соли железа (III) добавить немного раствора NH4SCN. Что наблюдается?
Записать уравнение реакции в молекулярном и ионном виде.
Опыт 5.3.3. Действие гексацианоферрата (II) калия K4[Fe(CN)6]
Катионы Fe3+ в кислой среде (рН = 2-3) реагируют с ферроцианидом калия – желтой кровяной солью с образованием темно-синего осадка берлинской лазури. Состав осадка чистой берлинской лазури описывают формулой Fe4[Fe(CN)6]3xH2O с переменным количеством молекул воды. Показано, однако, что, в зависимости от условий осаждения, осадок берлинской лазури, как и осадок турнбулевой сини (см. выше), увлекает из раствора другие катионы, так что его состав несколько изменяется и может соответствовать, например, формуле KFeIII[FeII(CN)6]. Поэтому все соединения данного типа называют «берлинскими лазурями».
Осадок берлинской лазури неустойчив в щелочной среде, но стабилен в кислом растворе, поэтому реакцию проводят в кислой среде при рН = 2-3.
Реакция образования чистой берлинской лазури протекает по схеме:
4Fe3+ +3[Fe(CN)6]4- ® Fe4[Fe(CN)6]3↓
Реакция высокочувствительна: открываемый минимум ~0,05 мкг, предельное разбавление ~106 мл/г. Мешают, как и при получении осадка турнбулевой сини, окислители и восстановители, в том числе катионы Fe3+, Zn2+ и Mn2+. Окислители окисляют ферроцианид до феррицианида, а восстановители восстанавливают железо (III) до железа (II).
Как и в случае турнбулевой сини, осадок берлинской лазури не растворяется в кислотах, разлагается при прибавлении раствора щелочи:
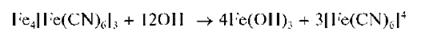
Реакция фармакопейная.
Выполнение опыта:
Налить в пробирку 1-2 мл раствора соли железа (III), добавить несколько капель соляной кислоты и немного раствора K4[Fe(CN)6]. Раствор окрашивается в синий цвет и выпадает темно-синий осадок берлинской лазури.
Записать уравнение реакции в молекулярном виде. Назвать продукт реакции.
Опыт 5.3.4. Реакция с сульфосалициловой кислотой
Катион Fe3+ реагирует в водных растворах с сульфосалициловой кислотой с образованием окрашенных комплексов.
В зависимости от рН среды и соотношения реагирующих компонентов состав и окраска образующихся комплексов могут быть различными. Так, при рН = 2-2,5 доминируют комплексы красного цвета, при рН = 4-8 - бурого и при рН = 9-11,5 - желтого. Наиболее устойчив комплекс желтого цвета, содержащий железо (III) и анионы сульфосалициловой кислоты в мольном отношении железо (III): сульфосалицилат-анион, равном 1: 3, т.е. на один атом железа приходятся три сульфосалицилатных лиганда. Этот комплекс доминирует в аммиачном растворе. Точное строение комплексов в растворе неизвестно.
Предполагается, что при рН = 9-11,5 реакция протекает с образованием трисульфосалицилатоферрат (III)-ионов [FeL3]3-:
3C6H3(OH)(COOH)SO3H + FeCl3 ® H3[(C6H3(O)(COO)SO3H)3Fe] + 3HCl
или по схеме:

где H2L - условное обозначение молекулы сульфосалициловой кислоты, а L2- - обозначение сульфосалицилат-аниона.
При обнаружении катионов Fe3+ реакцией с сульфосалициловой кислотой предельная концентрация железа (III) составляет 0,05 мкг/мл, т.е. реакция - высокочувствительная.
Сходные реакции катионы Fe3+ дают и с салициловой кислотой - ортооксибензойной кислотой HOC6H4COOH.
Реакция фармакопейная.
Выполнение опыта:
В пробирку внести 5 капель раствора соли железа (III), прибавить 10 капель раствора сульфосалициловой кислоты и 0,5 мл концентрированного раствора аммиака. Раствор принимает желтую окраску. Если вместо раствора аммиака прибавить 1 мл раствора HCl (1:1), то получают не желтый, а красный (фиолетовый) раствор.
Если реакцию провести со спиртовым раствором салициловой кислоты, то раствор окрашивается в темнофиолетовый цвет, при добавлении раствора аммиака окраска раствора меняется на красную.
Записать наблюдение и схему реакции в тетрадь.
Опыт 5.3.5. Реакция с сульфид-ионами
Катионы Fe3+ при взаимодействии с сульфид-ионами S2- в нейтральных или слабоаммиачных растворах образуют черный осадок сульфида железа (III) Fe2S3:
2Fe3+ + 3S2- ® Fe2S3
Осадок растворяется в минеральных кислотах.
Реакция фармакопейная.
Выполнение опыта:
В пробирку внести 3-4 капли раствора соли железа (III) и прибавить 2-3 капли раствора сульфида аммония (NH4)2S (или Na2S или сероводородной воды). Выпадает черный осадок сульфида железа (III).
Записать уравнение реакции в молекулярном и ионном виде виде.
Опыт 5.3.5. Окислительно-восстановительная реакция с йодидом калия
С избытком йодида калия соли трехвалентного железа образуют желто-коричневый раствор, вследствии образования свободного йода:
2FeCl3 + 2KI ® 2FeCl3 + I2 + + 2KCl
Выполнение опыта:
В пробирку внести несколько капель раствора соли железа (III) и прибавить избыток йодида калия. Наблюдать изменение окраски раствора. Записать наблюдаемое явление. Рассмотреть уравнение реакции с попощью метода электронного баланса.
5.4. Реакции катиона сурьмы (III) Sb3+
Опыт 5.4.1. Действие щелочей и аммиака (группового реагента)
При прибавлении раствора щелочи или 25% раствора аммиака к раствору, содержащему сурьму (III), выпадает белый осадок гидроксида сурьмы (III) Sb(OH)3, который можно также представить как сурьмяную кислоту H3SbO3 или HSbO2H2O:
Sb3+ + 3NH3 + 3H2O ® Sb(OH)3 ¯ + 3NH4+ или
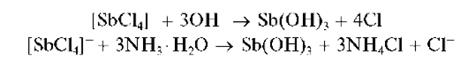
Свежевыпавший осадок Sb(OH)3 растворяется в избытке щелочи с образованием гидроксокомплексов [Sb(OH)4]-:
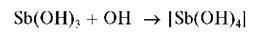
Осадок Sb(OH)3 растворяется также и в кислотах с образованием ацидокомплексов:
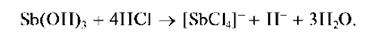
При действии щелочи в присутствии пероксида водорода H2O2 су-рьма (III) окисляется до сурьмы (V), давая белый осадок SbO(OH)3:
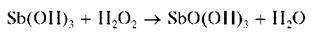
Выполнение опыта:
В 2 пробирки внести 3-4 капли солянокислого раствора сурьмы (III), прибавить 3 - 4 капли дистиллированной воды. Затем в одну пробирку по каплям - раствор NaOH до выпадения белого осадка Sb(OH)3. Продолжить прибавление по каплям раствора NaOH при перемешивании содержимого пробирки до растворения выпавшего осадка.
В другую пробирку прилить 2-3 капли 25% раствора аммиака.
Записать наблюдения и уравнения реакций в молекулярном и ионно-молекулярном виде.
Опыт 5.4.2. Реакция гидролиза
Гидролиз солей сурьмы идет даже при небольшом разбавлении их водой с образованием основных солей белого цвета:
[SbCl6]3– + H2O → SbOCl↓ + 5Сl– + 2Н+
[SbCl6]3– + 2H2O → SbO2Cl↓ + 5Сl– + 4Н+
Осадок оксохлорида сурьмы растворяется в избытке НС1 с образованием соответствующих комплексов:
SbOCl + 2Н++ 5Сl– → SbCl63– + H2O
Выполнение опыта:
3–4 капли соли сурьмы (III) разбавить водой до получения хлопьевидного осадка. Полученный осадок разделить на две части и исследовать на растворимость в растворе НСl.
Отметить наблюдения в тетради. Записать уравнения реакций в молекулярном и ионно-молекулярном виде.
Опыт 5.4.3. Реакция с сульфид-ионами
Сульфид-ион образует с солями сурьмы в кислой среде оранжево-красные осадки сульфидов, растворимые в избытке Na2S с образованием тиосолей:
2[SbCl6]3– + 3H2S→Sb2S3+ 6H+ + 12Cl–
Sb2S3 + 3S2–→2SbS3–
2[SbCl6]– + 5H2S→Sb2S5 + 10H+ + 12Cl–
В солянокислом растворе ионы Sb (III)присутствуют в виде комплексов SbCl63–.
Тиосоли сурьмы разлагаются под действием кислот, образуя сульфиды сурьмы.
Осадок сульфида сурьмы (III) растворяется также в концентрированной НСl при нагревании, в растворах щелочей:
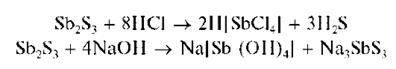
Выполнение опыта:
В пробирку поместить 3 капли солянокислого раствора хлорида сурьмы (III), 2 капли концентрированной HCl и прибавить по каплям раствор сульфида аммония (NH4)2S (или сульфида натрия Na2S) или сероводородную воду. Наблюдать выпадение оранжевого осадка сульфида сурьмы (III).
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 5.4.4. Реакция с тиосульфатом натрия Na2S2O3
При взаимодействии тиосульфата натрия Na2S2O3с солями сурьмы (III) в слабокислых растворах образуется красный осадок сурьмяной киновари Sb2OS2 (сероксид сурьмы (III) или сурьмяная киноварь):
2[SbCl6]3– + 2S2O32– + 3H2O → Sb2OS2 ¯ + 2SO42– + 6H+ + 12Cl– или
2Sb3+ + 2S2O32- + 3H2O → Sb2OS2 ¯ + 2SO42- + 6H+
Проведению реакции мешают ион Bi (III), образующий осадок черного цвета. В сильнокислой среде тиосульфат натрия разлагается.
Выполнение опыта:
Поместить в пробирку 2-3 капли раствора хлорида сурьмы, добавить несколько капель 1М раствора серной кислоты, бросить кристаллик Na2S2O3 и, при необходимости, нагреть на водяной бане. Образуется красный осадок Sb2OS2.
Записать наблюдение и уравнение реакции.
Опыт 5.4.5. Реакция восстановления Sb3+ до сурьмы Sb0
Сурьма (III) восстанавливается до металлической сурьмы в кислой среде металлическими магнием, алюминием, цинком, оловом, железом, например:
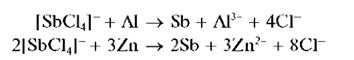
2SbCl63– + 3Sn → 2Sb↓ + 3Sn2+ + 12Сl– .
Металлическая сурьма выделяется в виде черного осадка на поверхности металла.
Выполнение опыта:
В пробирку внести несколько капель солянокислого раствора хлорида сурьмы (III) и кусочек металлического алюминия или цинка, либо железа. Поверхность металла чернеет вследствие выделения хлопьевидного оса
Дата добавления: 2020-11-18; просмотров: 1693;











