Опыт 6.1.7. Окрашивание пламени солями двухвалентной меди
Соли меди окрашивают пламя в изумрудно-зеленый цвет.
Выполнение опыта:
Платиновую или нихромовую проволоку погружают в концентрированную хлороводородную кислоту, затем в сухую соль меди и вносят в пламя газовой горелки или спиртовки, которое окрашивается в зеленый цвет.
Записать наблюдения в тетрадь.
6.2. Реакции катиона кадмия Cd2+
Опыт 6.2.1. Действие группового реагента гидроксида аммония NH4OH и щелочей
При прибавлении раствора щелочи или аммиака к раствору соли кадмия выпадает белый осадок гидроксида кадмия:
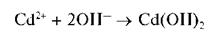
Осадок нерастворим в избытке щелочи, но растворяется в избытке аммиака с образованием бесцветного аммиачного комплекса [Cd(NH3)4]2+:
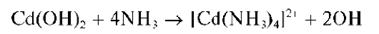
Осадок гидроксида кадмия растворяется в кислотах:
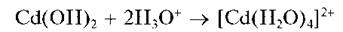
Выполнение опыта:
В две пробирки внести по 3-4 капли раствора соли кадмия. В одну пробирку прибавить 1-2 капли раствора NaOH или КОН. Выпадает белый осадок гидроксида кадмия Cd(OH)2.
В другую пробирку – по каплям раствор аммиака. Образующийся вначале белый осадок гидроксида кадмия растворяется в избытке аммиака.
Записать наблюдения и уравнения реакции в тетрадь.
Опыт 6.2.2. Реакция с сульфид-ионами
Катионы Cd2+ образуют с сульфид-ионами S2- в слабокислых или щелочных растворах желтый осадок сульфида кадмия CdS:
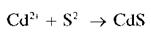
Осадок нерастворим в щелочах и в растворе сульфида натрия, частично растворяется в насыщенном растворе хлорида натрия с образованием хлоридного комплекса кадмия [CdCl4]2-:
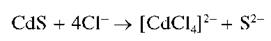
Сульфид кадмия нерастворим в кислотах, за исключением HCl, в которой он растворяется с образованием хлоридного комплекса кадмия:
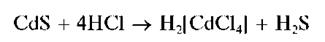
Выполнение опыта:
В пробирку внести 2-3 капли раствора нитрата кадмия, прибавить две капли раствора сульфида натрия Na2S. Выпадает желто-коричневый осадок сульфида кадмия CdS.
К выпавшему осадку прибавить по каплям насыщенный раствор хлорида натрия NaCl при перемешивании смеси до растворения осадка.
Записать наблюдения и уравнения реакции в тетрадь.
Опыт 6.2.3. Реакция с тетрароданомеркуратом (II) аммония
Катионы кадмия при взаимодействии с тетрароданомеркуратом (II) аммония (NH4)2[Hg(SCN)4] образуют белый кристаллический осадок тетрарода-номеркурата (II) кадмия Cd[Hg(SCN)4]:
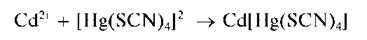
Реакция высокочувствительна: предел обнаружения составляет около 1 мкг, предельное разбавление равно 103 мл/г.
Выполнение опыта:
В пробирку внести 2-3 капли раствора соли кадмия и прибавить примерно столько же капель раствора (NH4)2[Hg(SCN)4]. Выпадают бесцветные (или белые - в зависимости от размера частиц осадка) кристаллы тетрароданомеркурата (II) кадмия Cd[Hg(SCN)4].
Реакцию можно проводить как микрокристаллоскопическую. Для этого на предметное стекло нанести каплю раствора соли кадмия и каплю раствора тетрароданомеркурата (II) аммония. При рассмотрении под микроскопом можно видеть образовавшиеся бесцветные продолговатые кристаллы тетрароданомеркурата кадмия Cd[Hg(SCN)4].
Записать наблюдения и уравнения реакции, зарисовать форму кристаллов в тетрадь.
Опыт 6.2.4. Реакция с тетрайодовисмутатом (III) калия
Катионы кадмия дают с тетрайодовисмутатом (III) калия K[BiI4] черный осадок йодида висмута (III) BiI3:
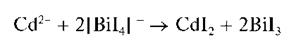
Осадок йодида висмута (III) растворяется при прибавлении избытка растворов йодида калия KI или тиосульфата натрия Na2S2O3.
Выполнение опыта:
На лист фильтровальной бумаги наносят каплю раствора тетрайодовисмутата (III) калия K[BiI4] и каплю раствора соли кадмия. На бумаге появляется черное пятно. При добавлении по каплям раствора йодида калия или тиосульфата натрия черное пятно исчезает.
Записать наблюдения и уравнения реакции в тетрадь.
6.3. Реакции катиона ртути (II) Hg2+
ВНИМАНИЕ! Все соединения ртути (II) сильно ядовиты, поэтому при работе с ними следует принимать меры предосторожности!
Опыт 6.3.1. Действие группового реагента гидроксида аммония NH4OH
При реакции с водным раствором аммиакакатионы Hg2+ образуют белые осадки. Из водных растворов хлорида ртути (II) HgCl2 выпадает белый осадок состава HgNH2Cl, из водных растворов нитрата ртути (II) Hg(NO3)2 - белый осадок состава [OHg2NH2]NO3:
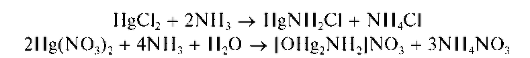
Осадки растворяются (лучше - при нагревании) в избытке аммиака, но только в присутствии солей аммония, с образованием бесцветного комплексного катиона тетрамминртути(II) [Hg(NH3)4]2+:
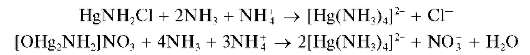
Выполнение опыта:
В одну пробирку внести 3-4 капли водного раствора хлорида ртути (II) HgCl2, а в другую - столько же водного раствора нитрата ртути (II) Hg(NO3)2. В каждую пробирку прибавить по каплям водный раствор аммиака до выпадения белых осадков. Затем в пробирки добавить по 3- 4 капли водного раствора соли аммония (NH4Cl или NH4NO3) и по каплям - водный раствор аммиака при перемешивании до полного растворения осадков.
Записать наблюдения и уравнения реакции в тетрадь.
Дата добавления: 2020-11-18; просмотров: 898;











