Работа 4. Реакции катионов четвертой аналитической группы
Цель: изучить характерные качественные реакции наиболее распространенных катионов IV группы, схему анализа катионов IV группы.
Задачи:провести реакции обнаружения катионов алюминия, цинка, хрома, олова и др., отметить их особенности, оформить лабораторную работу, ответить на теоретические вопросы, сделать выводы.
Оборудование:штатив с пробирками, водяная баня, плитка, пипетки на 1 мл, спиртовка, держатели для пробирок, спички, предметные стекла, микроскоп, платиновая, нихромовая или алюминиевая проволока, стеклянная палочка, фильтровальная бумага, стаканы, колбы, воронка для фильтрования, фарфоровые тигли, лакмусовая бумажка, цветная (черная) бумага, ножницы.
Реактивы:
| · сульфат алюминия Al2(SO4)3 | · нитрат цинка Zn(NO3)2 |
| · сульфат или нитрат хрома Cr2(SO4)3 или Cr (NO3)3 | · арсенит и арсенат натрия Na3AsO3 и Na3AsO4 |
| · хлорид олова (II) SnCl2 | · соль олова (IV) |
| · гидроксид натрия NaOH - 2 М и 20% растворы | · хлорид аммония NH4Cl – 4М раствор и сухая соль |
| · соляная кислота HCl - 2 М, конц., 10% раствор | · уксусная кислота CH3COOH – 0,05М, 2М раствор |
| · гидроокись аммония, раствор аммиака NH4OH – конц., · 2М раствор | · ализарин S (натриевая соль 1,2-диокси антрахинон-3-сульфокислоты) |
| · нитрат кобальта Co(NO3)2 | · карбонат аммония (NН4)2СO3 |
| · Гексацианоферрат (II) калия К4[Fe(CN)6] - насыщенный свежеприготовленный раствор | · алюминон (аммонийная соль ауринтрикарбоновой кислоты) - 0,01% раствор |
| · ацетат натрия CH3COONa | · оксихинолин 1% раствор |
| · ацетатный буферный раствор | · нитрат серебра AgNO3 |
| · гидрофосфат натрия Na2HPO4 - 2н раствор | · дитизон - 10% раствор в хлороформе |
| · тетрароданомеркуриат (II) аммония (NH4)2[Hg(NCS)4] | · серная кислота H2SO4 – 1М, 2М раствор |
| · перикись водорода Н2О2 - 3 % и 10% раствор | · персульфат аммония (NH4)2S2O8 – сухая соль |
| · амиловый спирт (с эфиром) | · йод I2 - раствор |
| · перманганат калия KMnO4 | · крахмал свежеприготовленный |
| · тетраборат натрия (бура) Na2B4O7 | · металлический цинк Zn - гранулы |
| · ацетат свинца (CH3COO)2Pb | · хлорид бария BaCl2 |
| · нитрат аммония NН4NO3 | · нитрат висмута (III) Вi(NО3)3 |
| · хлорид ртути (II) - сулема HgCl2 – спиртовой раствор | · гидрокарбонат натрия NaHCO3 – насыщ. раствор и сухая соль |
| · металлическое железо (железные опилки или стружка) | · сульфат меди (II) CuSO4 – разбавленный раствор |
| · молибдат аммония (NH4)2MoO4 | · гидроксид висмута (III) Bi(OH)3 |
| · азотная кислота НNO3 – конц. р-р | · йодид калия KI |
| · магнезиальная смесь (2-3 капли раствора MgSO4, 1-2 капли раствора аммиака и 4-5 капель раствора NH4Cl) | · сульфид натрия Na2S или аммония (NH4)2S – свежеприготовленный раствор |
4.1. Реакции катиона алюминия Al3+
Опыт 4.1.1. Действие щелочей (группового реагента)
Катионы Al3+ при реакциях с щелочами в растворах дают белый осадок гидроксида алюминия Al(OH)3, который растворяется в избытке щелочи с образованием гидроксокомплекса [Al(OH)6]3- (иногда гидроксокомплексам алюминия в растворе приписывают состав [Al(OH)4]-):
Al3+ + 3OН- → Al(OH)3↓
Al(OH)3↓+ 3OН- → [Al(OH)6] 3-
Наиболее полное осаждение гидроксида алюминия происходит при pH = 5-6. Осадок Al(OH)3 растворяется в кислотах, но не растворяется в аммиаке.
Выполнение опыта:
К раствору соли алюминия прилить 1-2 капли щелочи. Наблюдать образование осадка. Полученный осадок разлить в две пробирки. В одну пробирку добавить соляную кислоту, в другую - избыток щелочи.
Что наблюдается? На какие свойства гидроксида алюминия указывает это явления? Написать уравнения реакций получения осадка и растворения его в кислоте и в избытке щелочи.
Внимание! Последнюю пробирку (с алюминатом – растворенным осадком в избытке щелочи) оставить для следующего опыта.
Опыт 4.1.2. Действие хлорида аммония на растворы алюминатов
При добавлении солей аммония к щелочному раствору (особенно при нагревании), полученному после растворения гидроксида алюминия, гидроксокомплексы алюминия разрушаются, и снова выпадает осадок гидроксида алюминия:
[Al(OH)6] 3- + 3NH4+ →Al(OH)3↓ + 3NH3 + 3H2O
NaAlO2 + NH4Cl ® NH4AlO2 + NaСl
NH4AlO2 + 2HOH ® Al(OH)3↓+ NH4OH
Выполнение опыта:
К полученному в предыдущем опыте раствору алюмината прилить насыщенный раствор хлорида аммония или добавить несколько кристалликов этой соли. Раствор нагреть. Что наблюдается?
Записать в тетрадь молекулярные и составить молекулярно-ионные уравнения реакций.
Опыт 4.1.3. Реакция с аммиаком
Катионы Al3+ образуют с аммиаком, как и с щелочами, белый аморфный осадок гидроксида алюминия:
Al3+ + 3NH3 + 3H2O ®Al(OH)3¯ + 3NH4+
В избытке раствора аммиака осадок не растворяется, в отличие от действия щелочей.
Выполнение опыта:
Поместить в пробирку 4-5 капель раствора соли алюминия и прибавить к нему 5-6 капель 2М раствора NH3. Проверить растворимость гидроксида алюминия в избытке раствора аммиака.
Записать наблюдение и уравнение реакции в молекулярном и ионно-молекулярном виде.
Опыт 4.1.4. Реакция с нитратом кобальта
Катионы алюминя с нитратом кобальтаобразуют так называемую «тенаровую синь». При прокаливании соли алюминия, смоченной разбавленным раствором нитрата кобальта Co(NO3)2, образуется смешанный оксид алюминия и кобальта (алюминат кобальта) Co(AlO2)2 синего цвета - «тенаровая синь»:
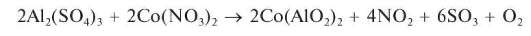
Мешают реакции катионы: Zn2+, Cr3+, Cu2+, Ni2+ и др. Реакция является фармакопейной.
Выполнение опыта:
Полоску фильтровальной бумаги смочить вначале 1-2 каплями раствора сульфата алюминия Al2(SO4)3, а затем 1-2 каплями разбавленного раствора нитрата кобальта. Бумагу высушить, поместить в фарфоровый тигель и озолить на плите. Получить золу синего цвета - «тенаровую синь».
Записать наблюдения и уравнения реакций.
Опыт 4.1.5. Реакция с ализарином
Ализарин S (натриевая соль 1,2-диокси антрахинон-3-сульфокислоты), а также некоторые его производные при реакциях с катионами Al3+ в аммиачной слабощелочной среде образуют малорастворимые комплексные соединения, имеющие сложное и не до конца установленное строение, ярко-красного цвета, называемые «алюминиевыми лаками»:
Al3+ + 3NH4ОН + C14H6O2(OH)2 ® Al(OH)2 C14H6O2(OH) ¯ + 3NH4++ H2O
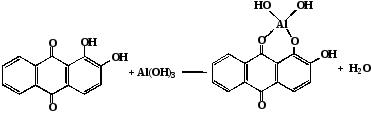
Комплекс устойчив в уксуснокислой среде. Реакция высокочувствительна. Мешают катионы, также образующие комплексы с ализарином: Zn2+, Sn2+, Cr3+, Mn2+, Fe3+ и др.
Реакцию можно выполнять капельным методом на фильтровальной бумаге.
Выполнение опыта:
На лист фильтровальной бумаги нанести 1-2 капли раствора соли алюминия. Бумагу подержать 1-2 мин в парах аммиака над склянкой с концентрированным раствором аммиака (под тягой!). Пары аммиака, соприкасаясь с влажным пятном, образуют на бумаге гидроксид алюминия.
На пятно нанести каплю раствора ализарина и снова подержать бумагу в парах аммиака. Пятно вначале окрашивается в фиолетовый цвет (цвет фона ализарина). Бумагу подсушить, нанести на нее 1-2 капли раствора уксусной кислоты и снова высушить. Пятно становится розово-красным.
Если в растворе одновременно с катионами алюминия присутствуют другие катионы, также дающие с ализарином комплексы, то капельную реакцию с ализарином проводят на фильтровальной бумаге, пропитанной раствором ферроцианида калия K4[Fe(CN)6]. При нанесении капли раствора на такую бумагу образуются малорастворимые ферроцианиды мешающих катионов, дающие темное пятно. А катионы Al3+, не дающие осадка ферроцианида, при прибавлении капли воды переносятся растворителем на периферию пятна, где после обработки парами аммиака и раствором ализарина образуют ализариновый комплекс алюминия. При высушивании бумаги фиолетовый фон ализарина исчезает, а красная окраска ализарин-алюминиевого лака - остается.
Записать уравнения реакции и наблюдения в тетрадь.
Опыт 4.1.6. Реакция с алюминоном
Катион Al3+ при взаимодействии с алюминоном - аммонийной солью ауринтрикарбоновой ислоты (обозначим ее для краткости NH4L) образует в уксуснокислой или аммиачной среде комплекс красного цвета (по-видимому, состава Al(OH)2L).
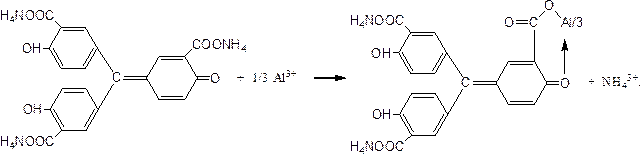
Реакция высокочувствительна. Мешают реакции катионы Ca2+,Cr3+,Fe3+, также образующие окрашенные комплексы с алюминоном.
Выполнение опыта:
В пробирку внести 3-4 капли раствора соли алюминия, 2-3 капли раствора уксусной кислоты и 3-5 капель 0,01 % раствора алюминона. Смесь нагреть на водяной бане, прибавить несколько капель раствора аммиака до щелочной реакции (проверить лакмусовой бумажкой) и 2-3 капли раствора карбоната аммония. Выпадает красный хлопьевидный осадок.
Записать наблюдения и уравнения реакции в тетрадь.
Дата добавления: 2020-11-18; просмотров: 2060;











